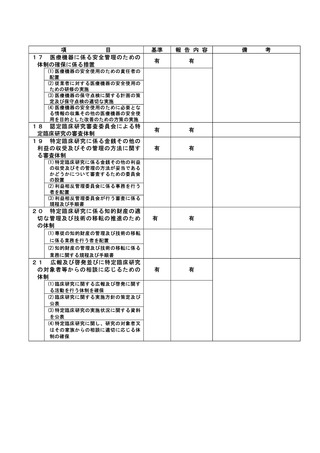
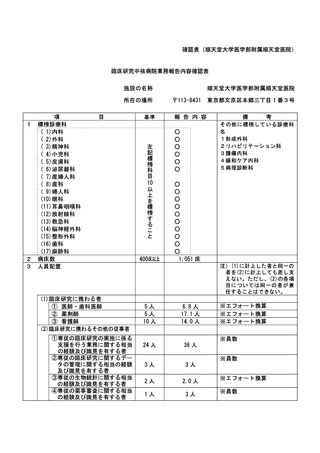
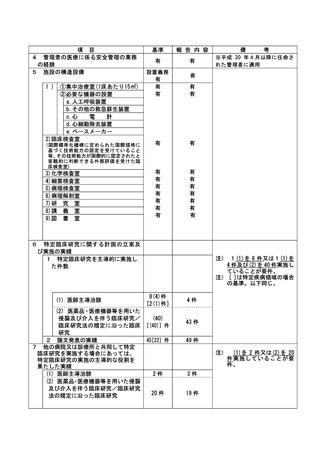
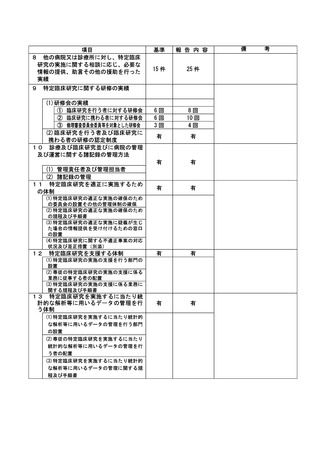
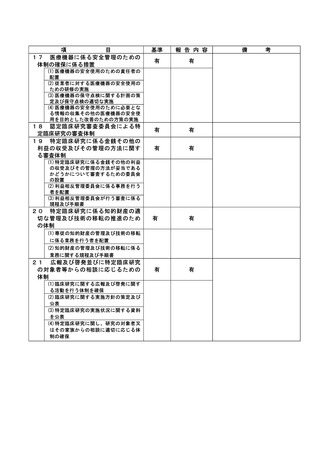
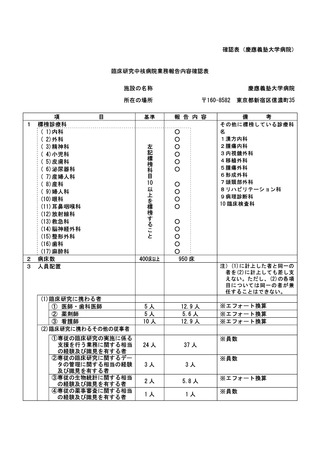
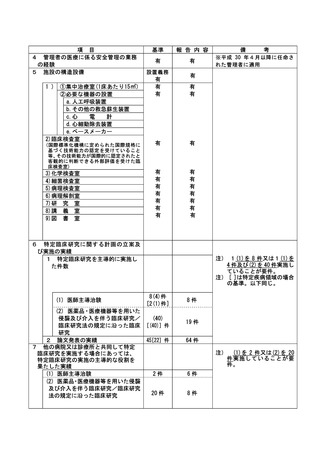
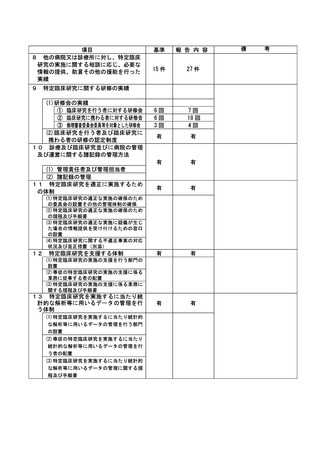
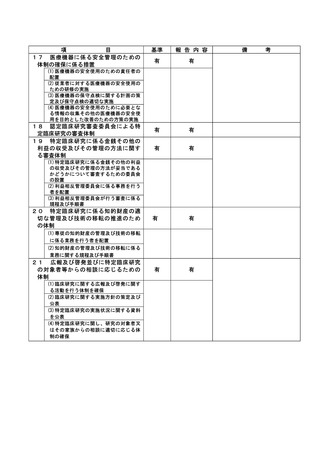
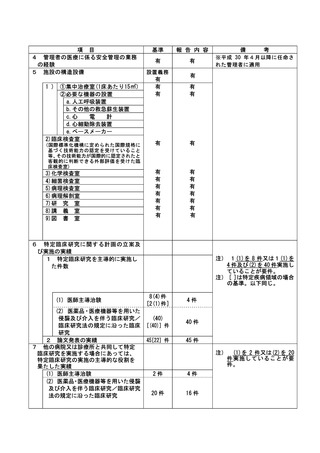
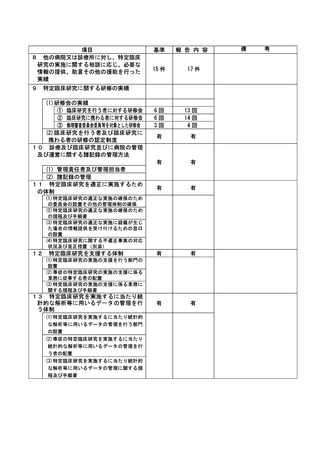
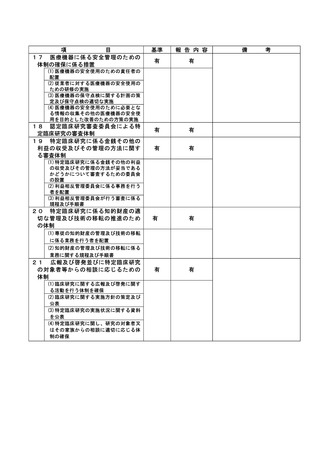
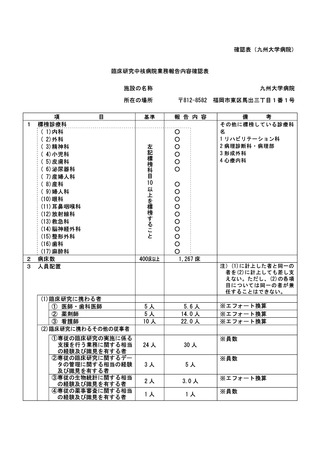
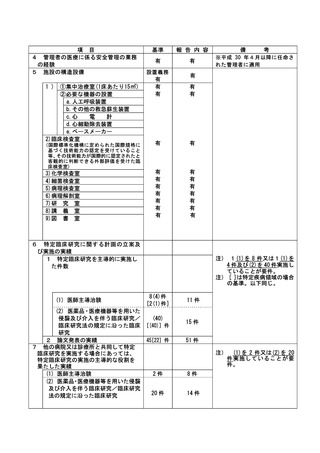
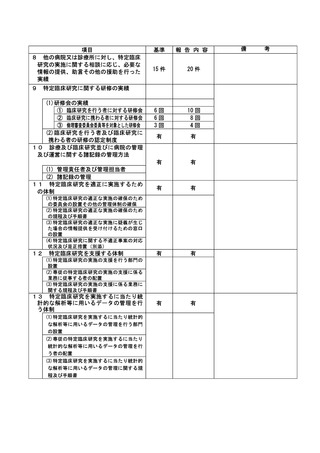
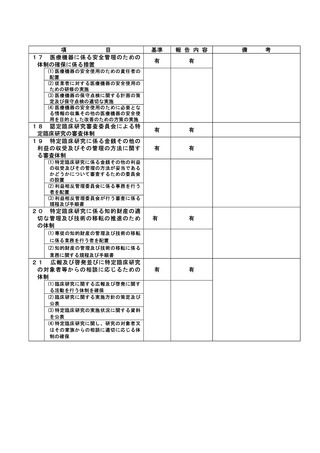
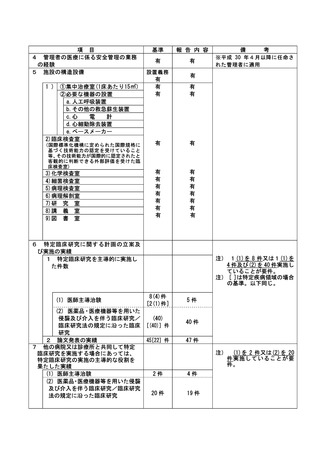
資料2:臨床研究中核病院業務報告内容確認表 (148 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
変更したものを使用していたとの申し出があり事案が発覚した。
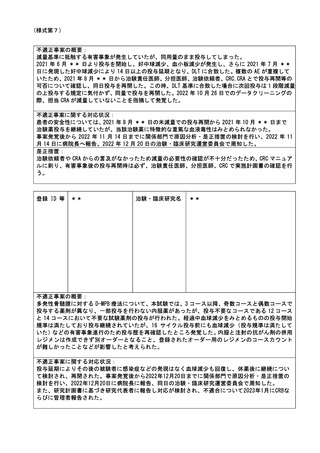
2022 年 10 月 21 日に研究対象者 24 例に対して臨床研究審査委員会未承認の調査票(5 種類)を用
いてデータ収集を行なっていたことが発覚し、研究責任医師より不適切事案として報告がなされ
た。
調査票の実施時期や内容の変更には臨床研究審査委員会へ報告し、再審査及び承認を要するとい
う認識が不足していた。
不適正事案に関する対応状況:
2022 年 10 月 12 日臨床研究センターは研究分担医師等との面談において本事案を知ることとなっ
た。
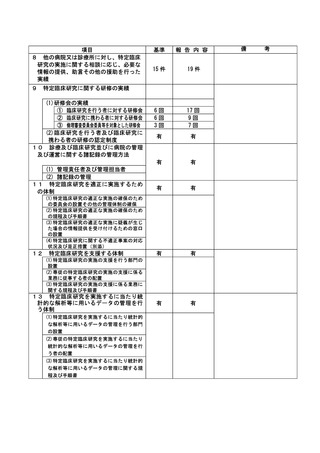
病院長より研究の中止は臨床研究審査委員会で決定するが、一時中断については臨床研究センタ
ーが判断して良いとの指示を受けていることから、2022 年 10 月 12 日に臨床研究センター管理ユニ
ットの指示により新規症例のエントリーを一時中断とした。
2022 年 10 月 21 日研究責任医師により詳細を確認したところ 24 例の研究対象者に対して臨床研
究審査委員会未承認の調査票を使用していたことが発覚し、その旨臨床研究審査委員会及び病院長
へ報告した。
2022 年 11 月 10 日に病院長より新規症例のエントリーの中断継続、調査票の変更申請手続きを行
うことと、実施中の対象者にはその時点で承認されている調査票を用いるように指示された。
2022 年 11 月 21 に開催された臨床研究審査委員会からは速やかな変更申請を行うように指示され
た。
その後、研究責任医師は調査票の変更申請を行い、2023 年 2 月 20 日に開催された臨床研究審査
委員会及び研究機関の管理者承認を得た。
是正措置:
調査票の実施時期や内容の変更には、事前に臨床研究審査委員会の承認と研究実施機関の管理者
承認が必要であることを再認識し、研究責任医師及び研究分担医師において周知を行った。
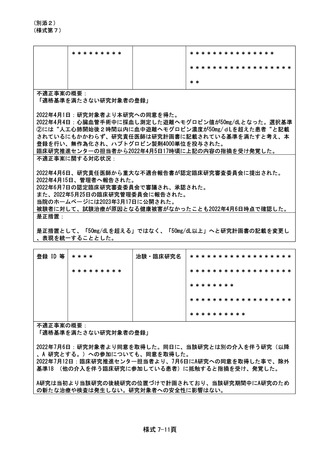
登録 ID 等
jRCTs071200097
治験・臨床研究名
妊娠後骨粗鬆症に対するカルシウムサプ
リメント投与が内分泌環境と骨微細構造
に与える影響に関する研究
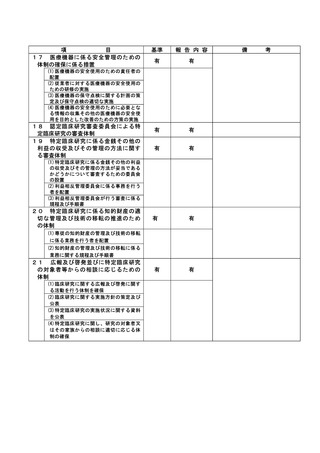
不適正事案の概要:
選択基準を満たしていない患者へ同意説明・同意取得した
2022 年 10 月 12 日の研究分担者との面談の時に臨床研究センター管理ユニットが当該研究の同意
文書の保管状況を確認していたところ、同意取得日が選択基準に合致しない者が複数あることに気
付いた。同日その場で研究分担医師および同席した研究医師以外の医師に確認したところ、選択基
準にて、分娩後 30 日以内で長崎大学病院産婦人科を受診した非妊娠時 BMI25 未満の褥婦を研究対象
と規定していたところを完全に満たしてはいない状態で同意取得していたことが発覚した。
2022 年 10 月 21 日に研究責任医師より詳細を確認したところ、19 例(分娩前の者、分娩後 30 日
以上経過した者、長崎大学病院産婦人科を受診前の者)に対して研究同意書を取得していたことが
発覚し、不適正事案として報告がなされた。
選択基準を完全に満たした対象者にのみ研究同意を取得するという認識が不足していたことも判
明した。
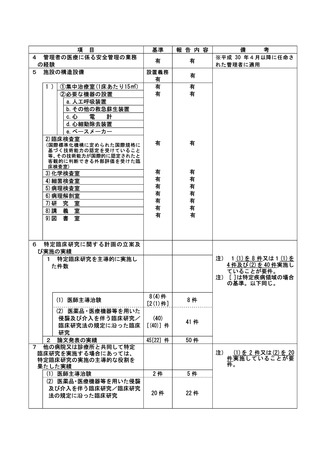
不適正事案に関する対応状況:
2022 年 10 月 12 日臨床研究センターは研究分担者等との面談において同意取得日の記録について
疑義照会し事案が発覚することとなった。
病院長より研究の中止は臨床研究審査委員会で決定するが、一時中断については臨床研究センタ
ーが判断して良いとの指示を受けていることから、2022 年 10 月 12 日に臨床研究センター管理ユニ
ットの指示により新規症例のエントリーを一時中断とした。
様式第7-13頁
147