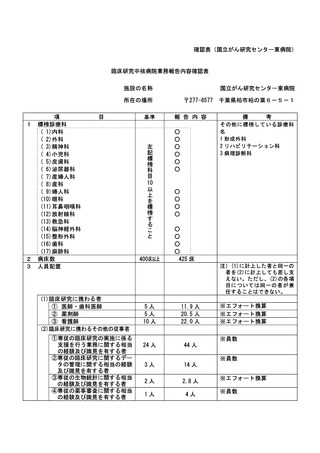
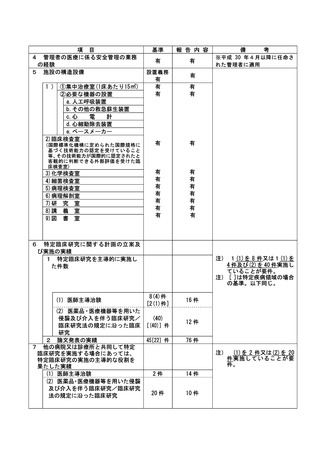
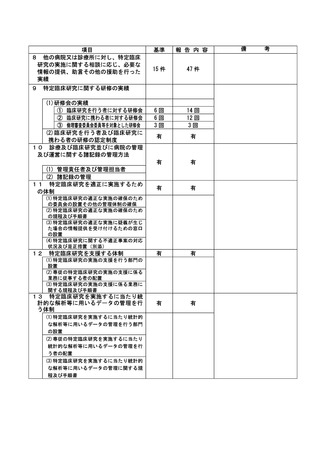
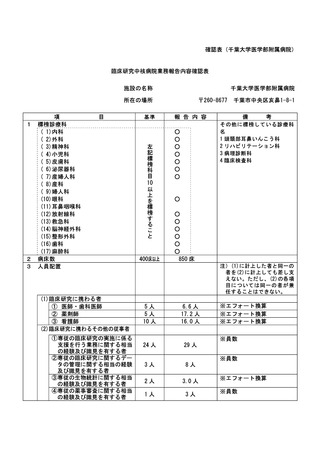
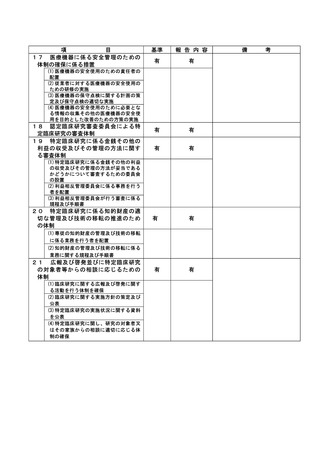
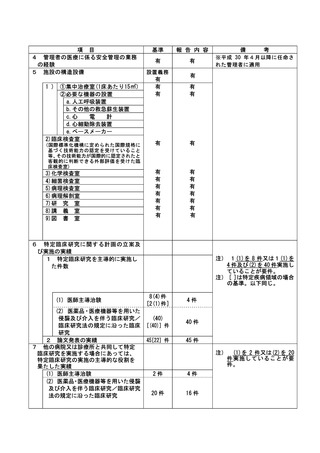
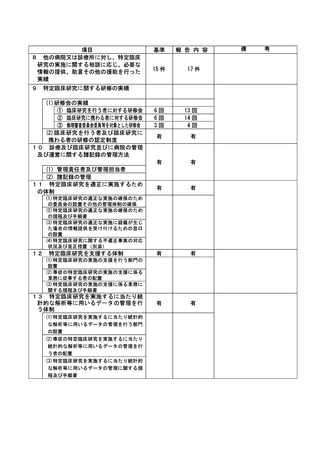
資料2:臨床研究中核病院業務報告内容確認表 (116 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
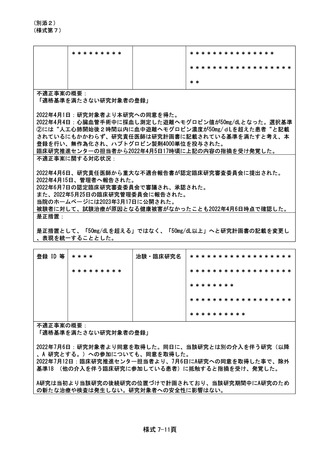
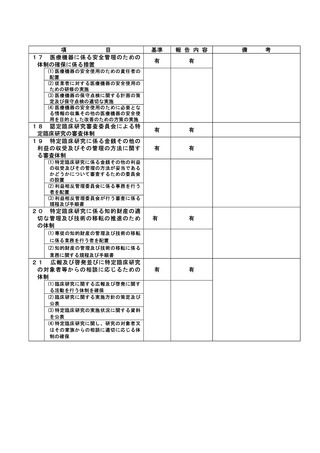
(様式第7)
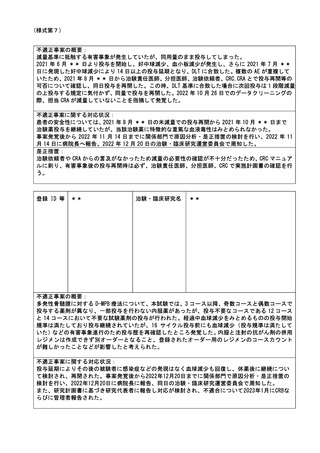
とともに、必要に応じて報告内容に係る関係資料について情報収集を行い、必要があれば関係
職員等に委員会への出席を求め.意見または説明を聴いたうえで、事実関係の把握を行い、こ
れら報告内容や把握した事項等に基づき、審議を行う。「神戸大学特定臨床研究監査委員会」
は、これらの審議の結果、不適切な行為等が判明した場合は、学長及び病院長に対し、当該事
案の調査、特定臨床研究の実施に関する改善又は中止の指示、再発防止策の策定等について、
是正措置を講じるよう意見を述べる。
なお、特定臨床研究にかかる不適正事案が発生した場合等、臨時で委員会を開催し、病院長か
ら報告を求め、上記と同様に指示・勧告を行う。
2022 年度は、12 月 7 日及び 2023 年 3 月 23 日に特定臨床研究監査委員会を開催した。
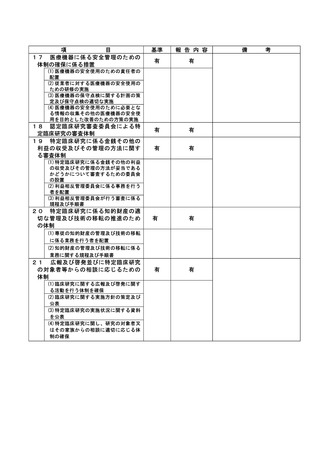
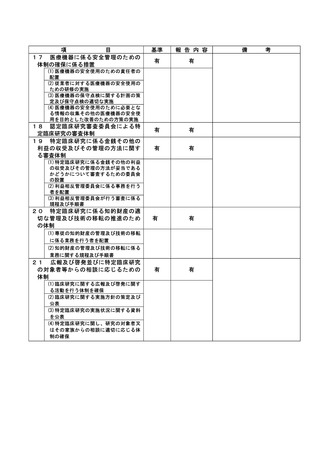
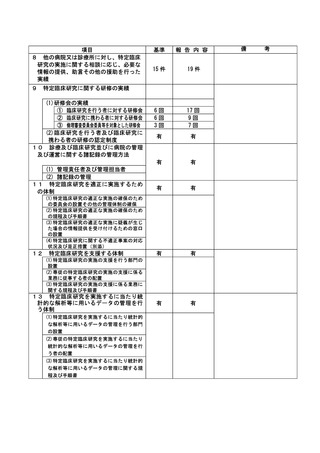
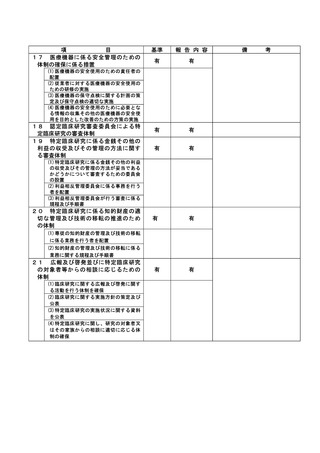
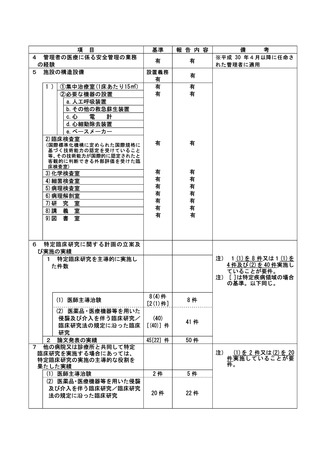
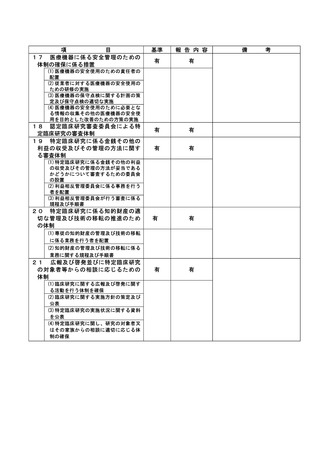
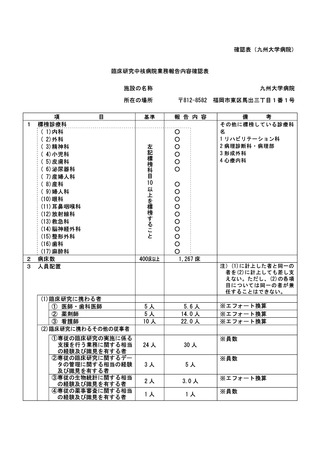
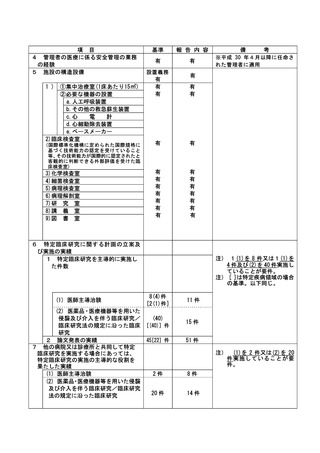
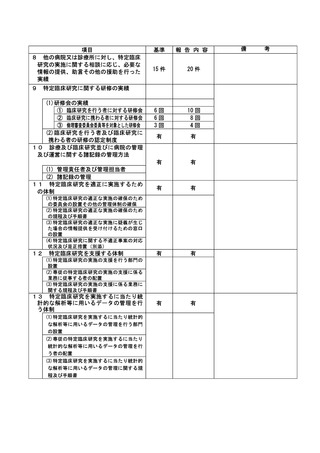
(注)病院管理者の業務執行の状況を監査するための委員会の設置規程【資料 7-36 P.245~P.246】、
構成員名簿【資料 7-36-2 P.247】、今後の開催予定がわかる資料を添付すること。【資料 7-363 P.248】
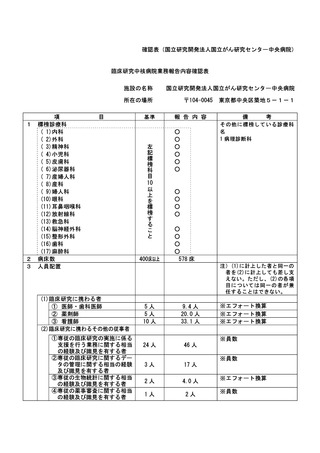
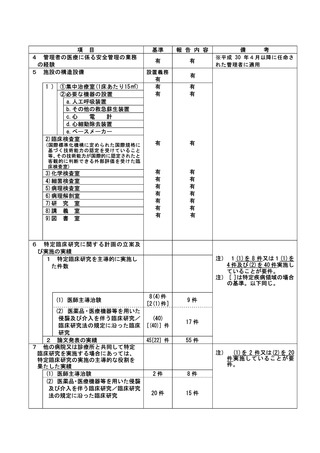
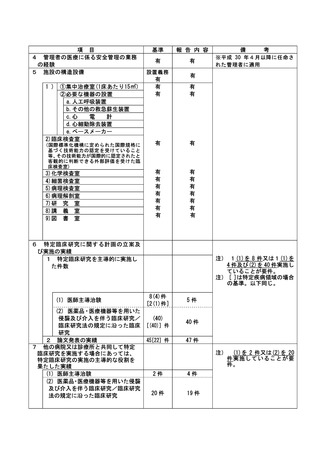
3
1
特定臨床研究に関する不適正事案
登録 ID 等
****
治験・臨床研究名
*********
******************
******************
******************
********
不適正事案の概要:
「適格基準を満たさない研究対象者の登録」
研究計画書4.1項の選択基準(3)には、糖尿病と診断されている場合は、食事療法及び運動療法のみ
、もしくは糖尿病治療薬による安定した治療を受けており、HbA1c 8.0g/dl 未満の患者(同意取得
前30 日以上の間、同一の薬剤、用法・用量で安定していること)としているが、2022年2月28日に
新たな薬剤を処方した被験者を2022年3月28日に同意取得し登録した。研究責任医師が同意取得前28
日以上と規定していると誤認して同意取得、登録、介入開始としてしまった。2022年3月31日、臨床
研究法サポートチームから選択基準(3)に抵触するため重大な不適合である旨を指摘され、同日患者
本人に連絡を取って謝罪し、中止・介入終了となった。
不適正事案に関する対応状況:
2022年4月4日、研究責任医師から重大な不適合報告書が認定臨床研究審査委員会に提出された。
2022年4月15日、管理者へ報告された。
2022年5月9日の認定臨床研究審査委員会で審議され、承認された。
また、2022年5月25日の臨床研究管理委員会に報告された。
当院のホームページには2023年3月17日に公開された。
被験者に対して、試験薬を3日間服用したことによる健康障害は認めなかった。研究開始前に所定の
検査をして3日しか経過していないことから、中止時に反映する必要性が乏しいと判断し、被検者へ
の負担をかけないため中止時の検査は省略することとした。
是正措置:
是正措置として、症例登録前に研究責任医師または研究分担医師と症例登録票を確認する事務担当
者においてダブルチェックをすることとした。
登録 ID 等
****
治験・臨床研究名
******************
様式 7-10頁
115