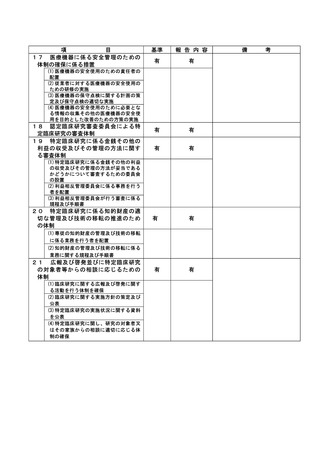
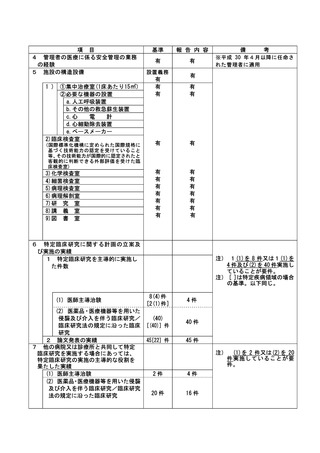
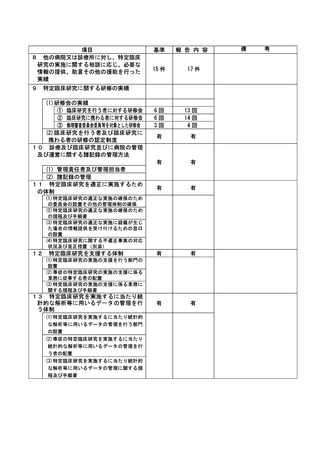
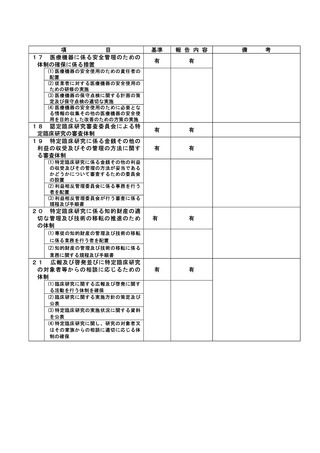
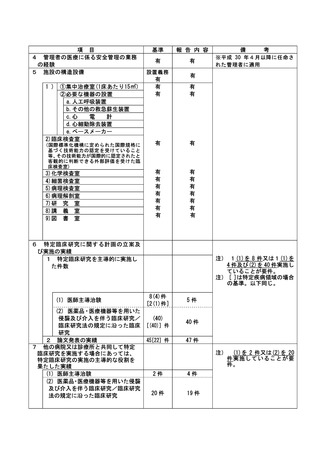
資料2:臨床研究中核病院業務報告内容確認表 (66 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
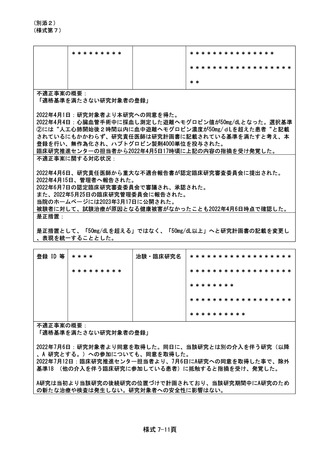
また上記「判定通知書(2023年2月27日付)」による通知事項(1)および(2)への対応の結果、当該研
究分担医師の利益相反事実確認を受けたこと、その結果、CRB承認済みの当院「利益相反管理計画(
様式E)」について、内容に変更はないことが報告された。
同じく付記事項(3)について、研究事務局より、当該追加研究分担医師に利益相反がない場合は、CRB
への申請内容に齟齬がないため、次回の CRB 申請時に報告することとし、当院管理者へ確認の上で当
該医師は本研究に参加することも可能である旨の見解を得た旨が報告された。
再発予防のため、CRB へ利益相反管理計画(様式 E)を提出する際は、事前に所定の手続きにて事実
確認を受けるべきことを確認した旨が報告された。
(注)1
2
不適正事案に関する調査の概要(方法、期間、結果等)を記載すること。
調査報告書その他関係書類が取りまとめられている場合は、添付すること。
様式 7-14
65