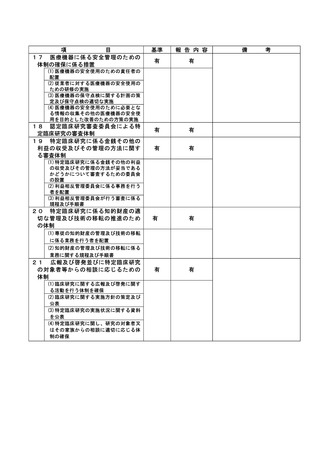
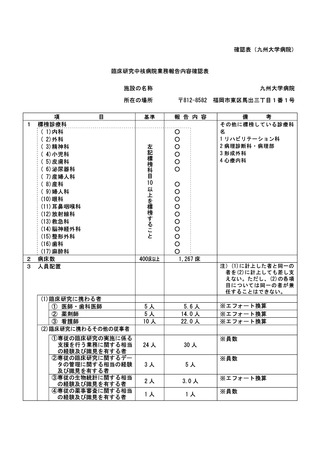
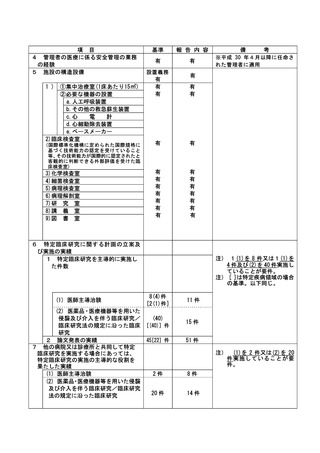
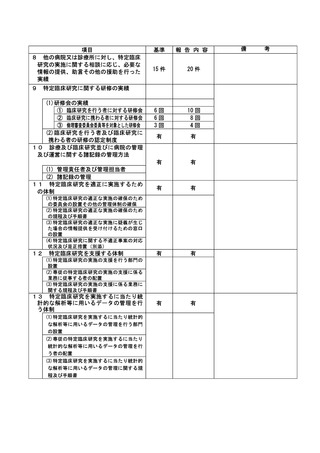
資料2:臨床研究中核病院業務報告内容確認表 (144 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
3
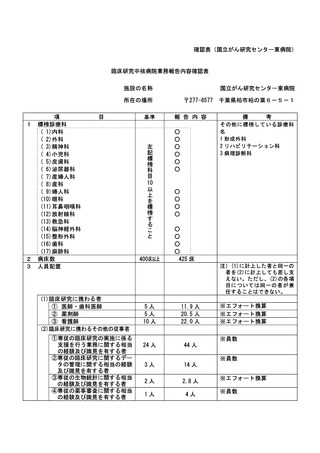
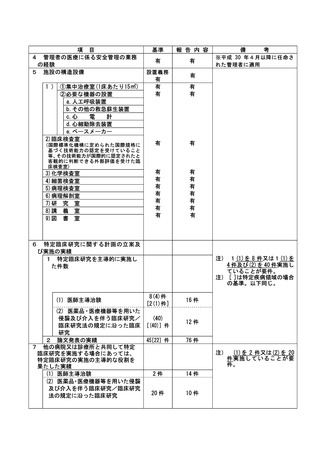
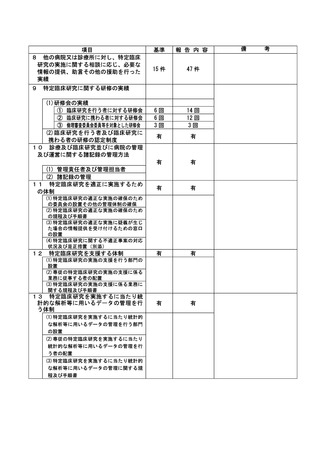
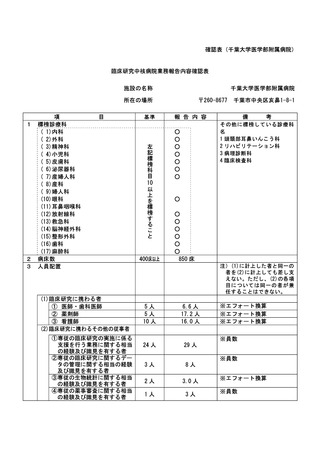
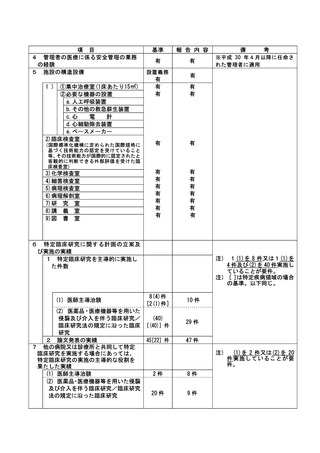
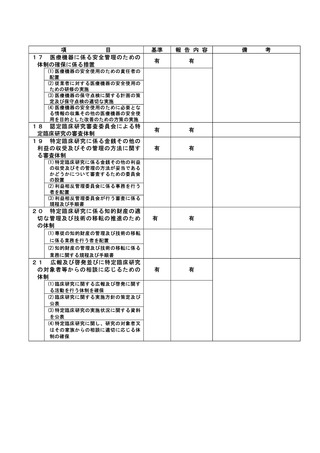
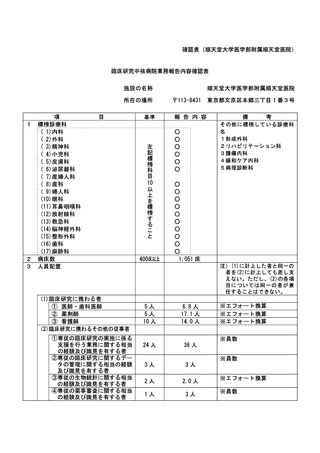
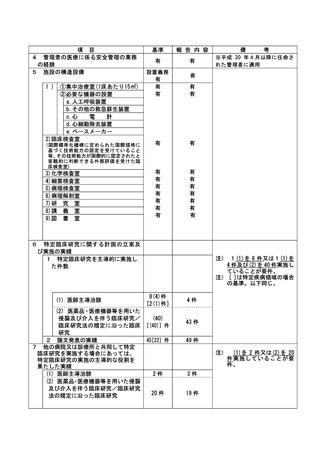
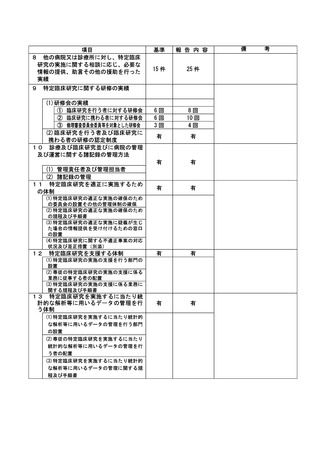
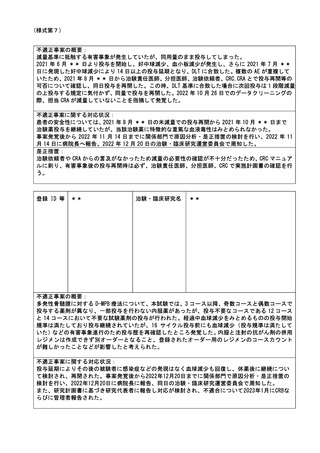
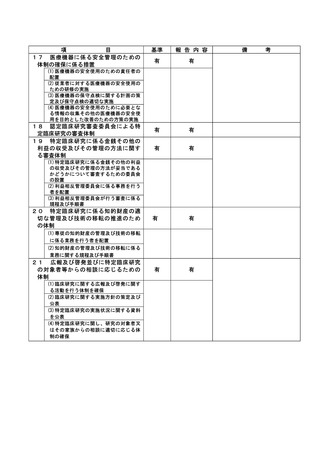
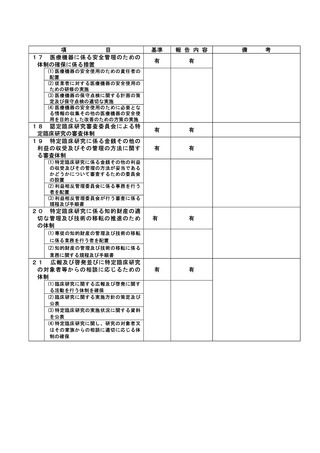
特定臨床研究に関する不適正事案
登録 ID 等
22-1395
治験・臨床研究名
RTA402 第Ⅲ相臨床試験(糖尿病性腎臓病
患者を対象としたプラセボ対照ランダム
化二重盲検比較試験)
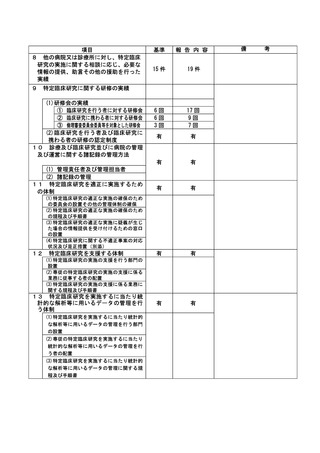
不適正事案の概要:
研究用検体(採血、採尿)の不要な採取
治験に付随して、治験薬投与期間中は研究用検体採取を 12 週毎に行う治験で、治験薬中止後の評
価日では採取不要であった。当該患者からは、研究用検体採取に対する同意は取得していたが、治験
薬中止後、研究用検体を 2022 年 4 月 13 日に採取し、担当モニターのモニタリング時(2022 年 4 月
14 日)に発覚した。
CRC 2 名で、患者用のスケジュール表を確認し準備を行っていた。研究用検体採取があったため同
意文書を取得していることを確認して準備を行ったが、治験薬中止後は採取不要であると記載した
注釈をプロトコールで確認していなかった。
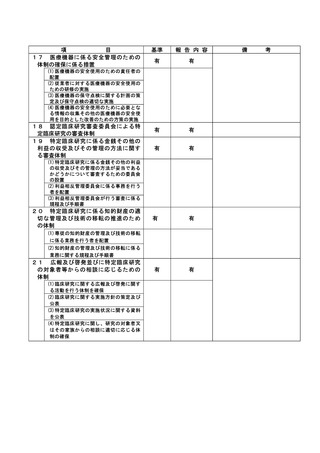
不適正事案に関する対応状況:
2022年4月14日のモニタリングで指摘を受け、担当モニターより依頼者へ報告。患者の直近の来院
日である2022年5月11日に、分担医師とCRCで患者へ不要な検体採取を行ったことを謝罪し、「わか
りました」と了承していただいた。
検体の取り扱いについては、2022 年 12 月1日担当モニターを通じて、「依頼者より被験者へ検体
の廃棄について説明し、破棄の意思確認が必要と指示があった」と電話で受け、2023 年 4 月1日受
診時に、分担医師から検体破棄について説明し、了承を得た。(カルテ記載)破棄証明書(2023 年1
月 5 日付け)を責任医師ファイルに保管。
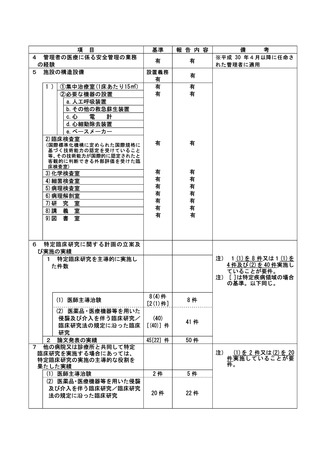
是正措置:
1.誰が見てもわかるように、担当 CRC は、不要になった検査は、患者用スケジュールから削除す
る。
2.担当 CRC は、検査が不要になった時点で、その患者用に提供されていた資材を破棄する。
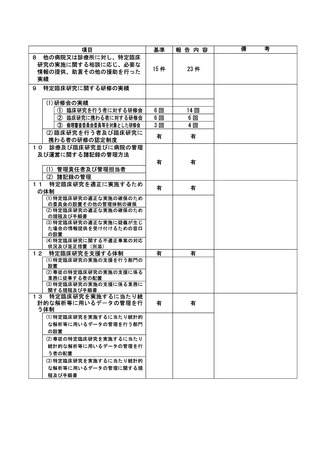
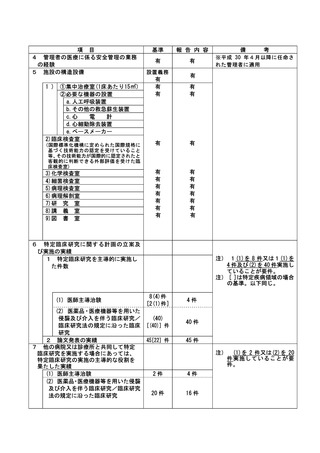
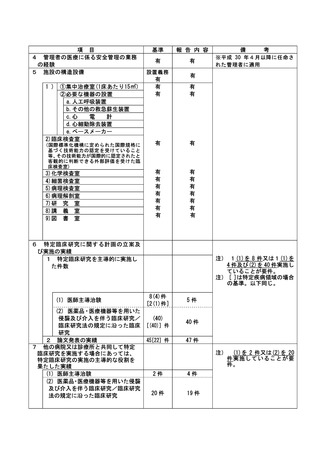
登録 ID 等
jRCT2073210094
治験・臨床研究名
表在性非乳頭部十二指腸上皮性腫瘍に対
する腹腔鏡内視鏡合同手術における
TERGS0001 の探索的治験
不適正事案の概要:
内視鏡検査での腫瘍径測定手順の不順守
本治験の適格性確認時の内視鏡検査による腫瘍径の測定方法は、「メジャー鉗子を用いて腫瘍の長
径を作成し、測定時の内視鏡画像は動画で保存する。」と規定されていた。適格性判定委員会で 4 例
目の適格性確認が行われた際、メジャー鉗子での腫瘍径の測定を問われ、メジャー鉗子を用いての測
定は実施できていないことがわかった。また、適格性判定委員会で検討した 4 症例において、メジャ
ー鉗子での腫瘍径の測定及び内視鏡画像の動画保存が実施されていなかったことを確認した。
2022 年 7 月 4 日に適格性判定委員会が行われ、この時に腫瘍径をメジャー鉗子で測定していない
こと、測定方法の不順守および、内視鏡の動画はあるがその動画の中でメジャー鉗子での画像がない
ことが発覚した。
不適正事案に関する対応状況:
4 例目については、15 ㎜以上ではない可能性があり、適格性委員会にて腫瘍径含めその他の適格性
についても判定し、不適格となった。責任医師より、患者へ適格性判定委員会でも本症例が不適格で
あることが判断され、今回の治験の対象ではなかったことを説明し、患者より了承を得た。責任医師
より、事前に適格性判定委員会で判定し、治験に参加できないことがあることは説明されていた。
様式第7-9頁
143