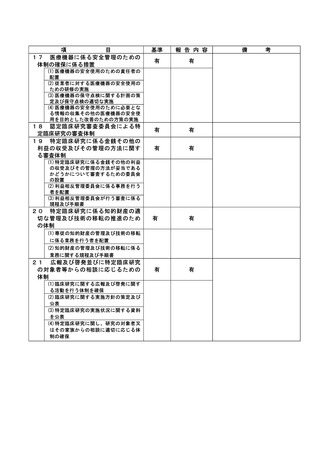
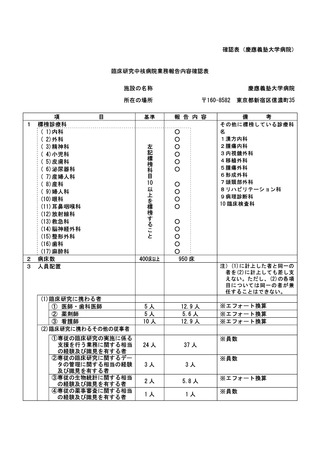
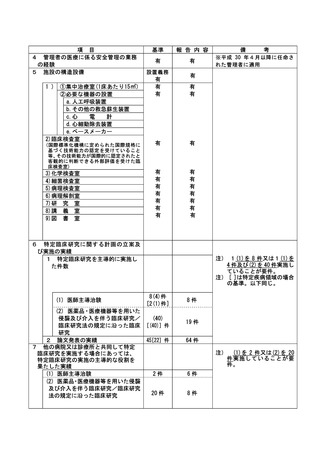
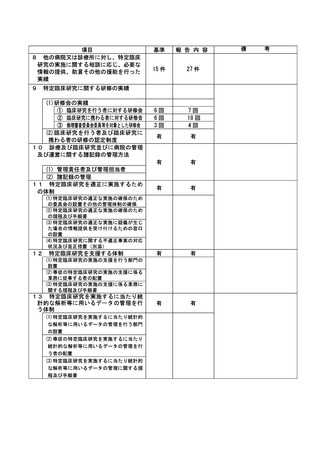
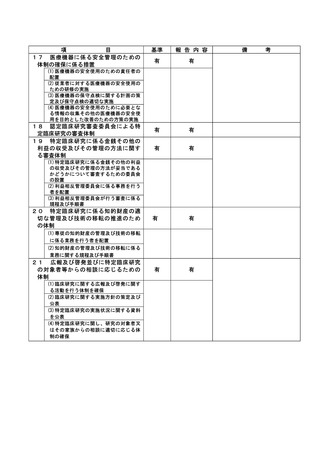
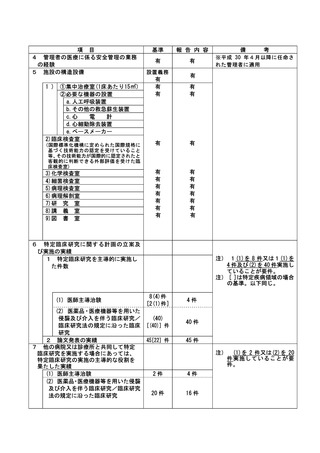
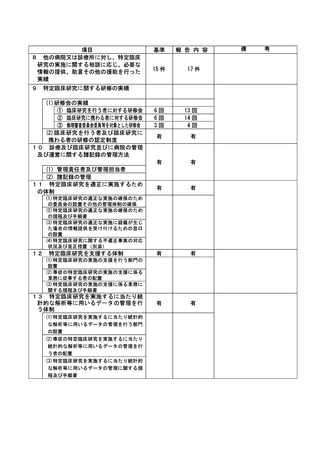
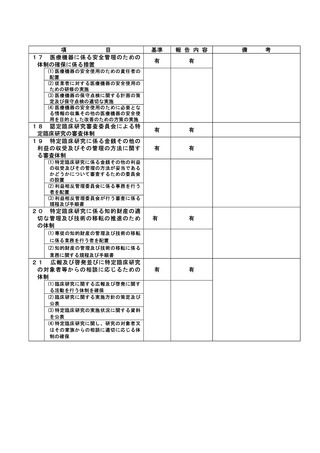
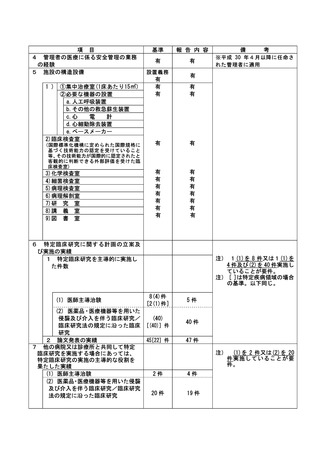
資料2:臨床研究中核病院業務報告内容確認表 (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
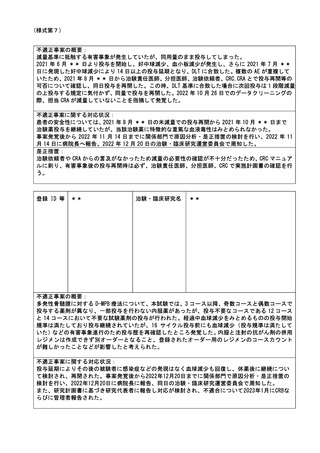
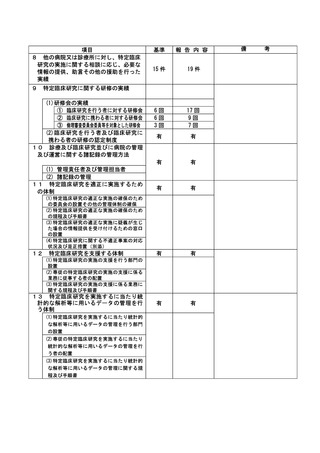
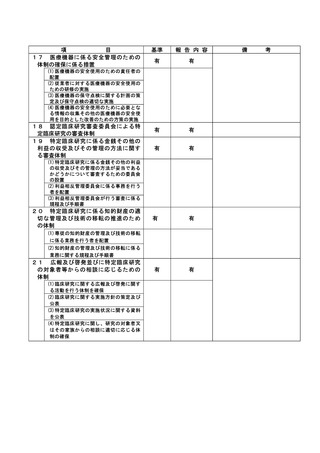
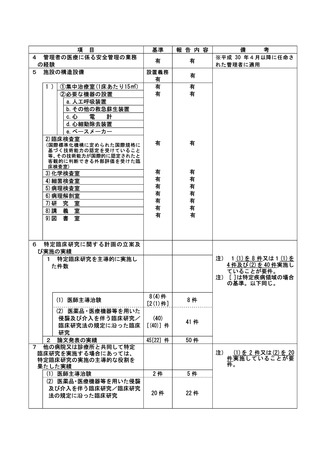
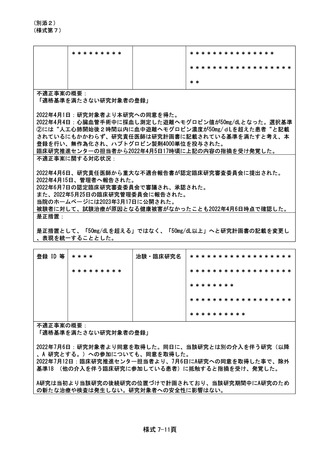
登録 ID 等
**
治験・臨床研究名
**
不適正事案の概要:
同意説明文書の未許可版使用
研究計画の改訂後に、すでに研究に参加している4名の被験者から再同意を取得したが、使用した同意説
明文書はその時点(2022年2月22日〜3月25日)で病院長の許可を得ていなかった。2022年11月24~25日に
モニタリング担当者により判明した。
以下、2021年度の経緯:
2022年2月3日の学校法人昭和大学臨床研究審査委員会(CRB)の審議で、同意説明文書(第1.6版)の改
訂が承認された。CRB承認後、研究事務局を介して研究責任医師は2月4日にCRB承認書類の管理者の実
施許可依頼を受け、2月7日時点で管理者許可済であることを誤って研究事務局に連絡した。全実施医療機
関の管理者の実施許可済の連絡を受け、研究事務局は2月21日に関東信越厚生局へ提出し、2月22日にj
RCT変更公開となった。その後、当院の病院長許可手続きにおいて資料提出が行なわれていないことが判
明したため、同意説明文書(第1.6版)の変更を3月9日に改めて申請し、3月25日に病院長許可を得た。
不適正事案に関する対応状況:
研究対象者の健康被害はなかった。2023年1月5日に本事案を不適合報告として病院長に報告し、2月24日
開催の特定臨床研究管理委員会で了承した。また、3月6日付にて病院長および臨床研究監理センター長
名で、研究代表医師に厳重注意をおこなった。
是正措置:
審査申請システムの本研究課題の申請者として、研究責任医師の他に、研究事務局担当者、研究協力者
を新たに追加し、現在の管理者許可・報告状況を可視化する体制に変更した。
改訂版の同意説明文書を使用する際は、当院の院内実施許可、jRCT 変更公開状況を確認した上で使用
する。
登録 ID 等
**
治験・臨床研究名
**
不適正事案の概要:
心電図モニターの誤中止
2022/12/31 8:00 に心電図モニター履歴を確認しようとしたところ、前日 12:30 の担当主科(呼吸器外科)の
医師(研究分担者ではない)の指示によりモニターが中止されていることが判明した。当該指示に関して、責
任医師と主科医師の(時間差のある)二重指示によるモニター誤中止が原因であった。
不適正事案に関する対応状況:
事案の判明後すぐにモニターを再開した。研究目的の検査が一時中止となったが、研究対象者の健康被害
はなく、本事案に関する対応は不要と判断した。2023 年 1 月 4 日に本事案を不適合報告として病院長に報
告し、2 月 24 日開催の特定臨床研究管理委員会で了承した。また、3 月 6 日付にて病院長および臨床研究
監理センター長名で、研究代表医師に厳重注意をおこなった。
是正措置:
指示簿記載に「責任医師の許可なく心電図モニターを絶対に中止しないでください」との明記を追記するとと
12