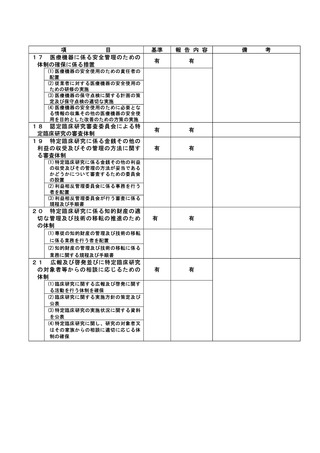
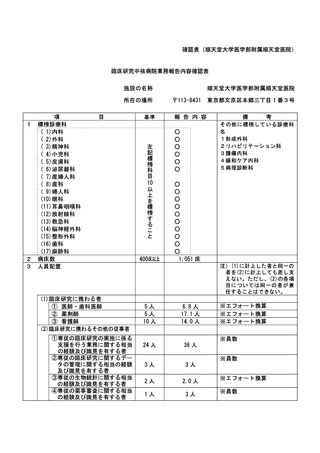
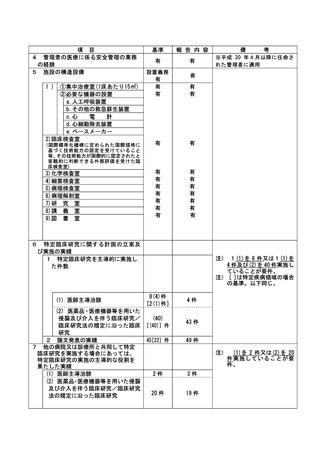
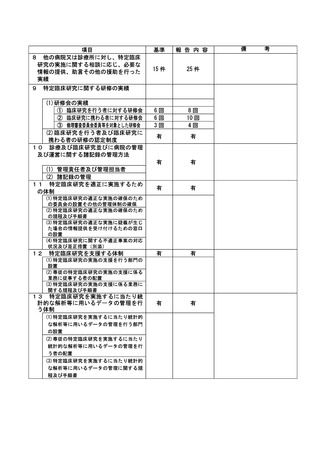
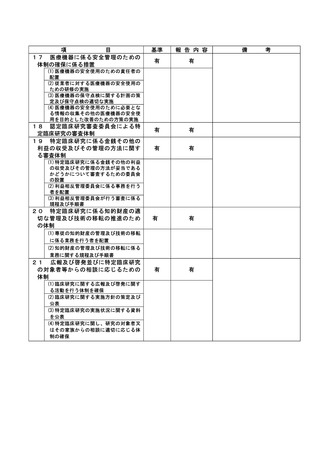
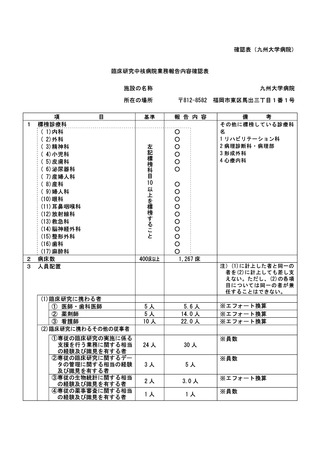
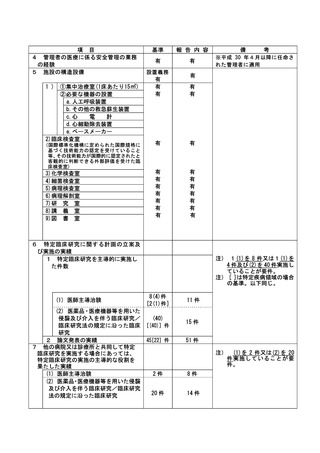
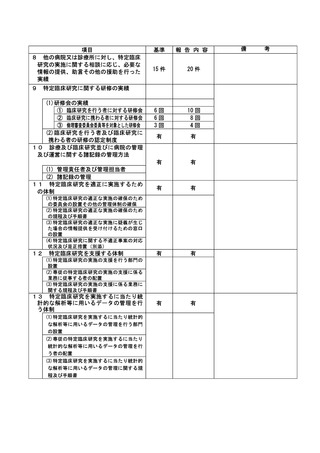
資料2:臨床研究中核病院業務報告内容確認表 (82 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
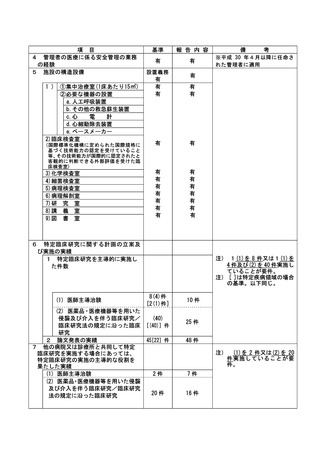
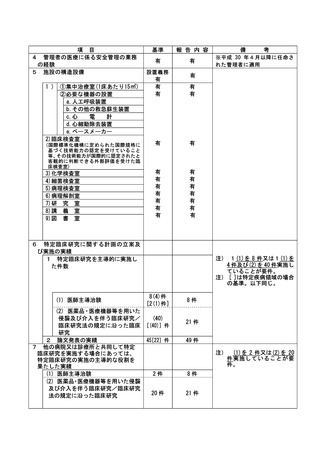
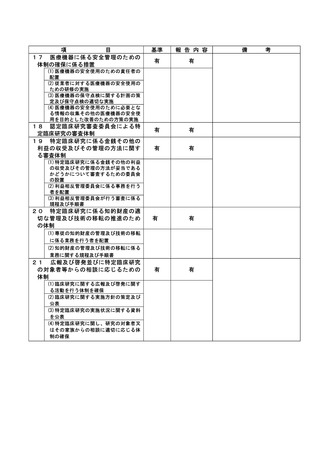
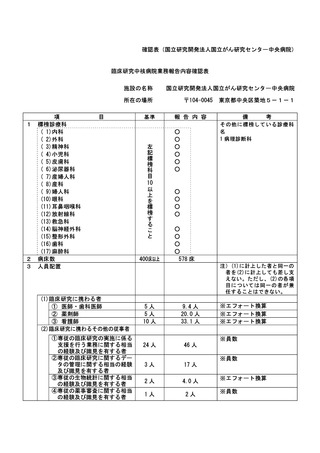
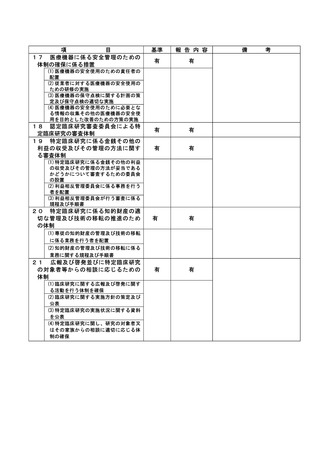
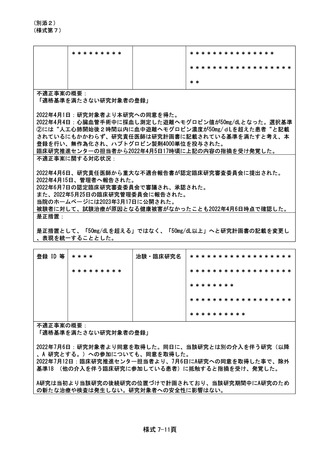
不適正事案に関する対応状況:
状況:
2021 年 4 月に研究期間を延長する変更申請(研究終了日 2021 年 12 月 31 日→2022 年 12 月 31 日)
がなされたが、研究期間の延長のみで、症例集積期間及び診療情報等の収集期間の更新が申請されて
いなかったことが、2022 年 4 月の定期報告時に判明した。計画書上の症例集積期間を超えて組み入
れた症例数は 6 例であった。
対応:
2022年4月27日のCRBにて重大な不適合事案に該当することを見出し、症例登録を一時中断し早急に
研究計画書の修正を行うよう担当医師宛にメールにて伝えた。
これを受けて担当医師にて不適合報告及び計画変更申請書類を作成の上、5月3日に計画変更申請が
、5月6日に不適合報告がそれぞれCRB事務局宛に提出された。
当該不適合報告をもって、CRB事務局より5月9日にCRB委員長へ、5月10日に病院長へ報告を行った。
また、申請された計画変更に基づき、症例集積期間の延長等について5月13日にCRBが承認し、5月17
日に病院長が改めて実施許可を出したため、症例登録の再開を認めた。
なお、6 例はいずれも共同研究機関(4 施設)での登録であるため、当該施設に再同意を取得するよ
う担当医師を通して指示した。
令和 4 年 7 月 13 日開催の特定臨床研究管理委員会にて報告した。
是正措置:
研究事務局、CRB 並びに CRB 事務局による複数の視点で確認を行うことで、今後同様の変更漏れが発
生しないように再発防止を徹底する。
登録 ID 等
**
治験・臨床研究名
**
不適正事案の概要:
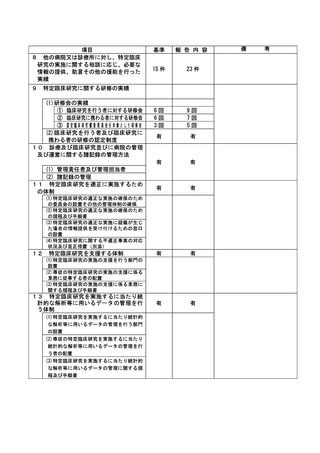
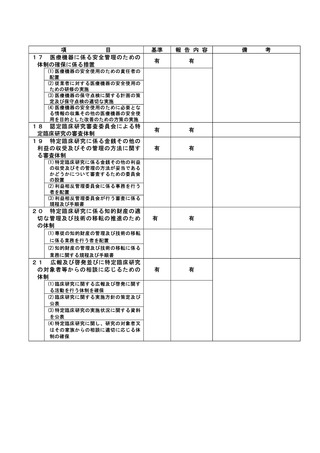
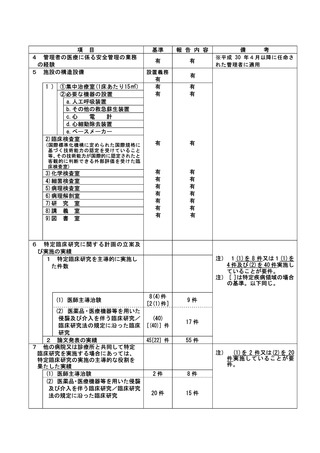
③除外基準への抵触
不適正事案に関する対応状況:
状況:
2022 年 5 月 23 日~25 日に行われた研究事務局による data review の結果、本試験適格と判断され
て登録実施された 4 例について、前治療の最終投与から登録まで 28 日が経過していないことから、
除外基準の一つである「前治療に抗癌治療を施行した場合、登録時点の少なくとも 28 日前に最終投
与をしていること。」(計画書除外基準 4)に抵触する可能性があることが判明した。
このことを受けて、5 月 26 日に研究責任医師は CRB 事務局に不適合報告を行った。
なお、該当症例について、いずれも試験治療開始直後の予期されない重篤な骨髄抑制は認めておら
ず、他の予期される有害事象の発生は認めるものの、いずれも軽快、回復を確認している。
また、いずれの患者も当該試験治療にて無増悪経過観察中または当該試験治療による病勢コントロ
ール後の増悪に対してさらに後治療が実施できている経過であり、該当症例を組み入れた分担機関
の各責任医師に、臨床研究対象者の患者さんに対する影響について、それぞれの事例ごとに確認し
た。今回の各事例は、臨床研究対象者の各患者さんの進行非小細胞肺癌に対する治療経過に重大な影
響を及ぼしたものではないと考えられる見解であることを各責任医師から確認した。
対応:
6月22日開催のCRBにて本事案が「重大な不適合」に該当するものと判断し、7月27日開催のCRBにて
研究責任医師に対してヒアリングを行った。ヒアリングの結果、各機関の責任医師による除外基準
の確認が十分でなかったこと、判断に迷うことがあれば研究事務局に相談するように周知が徹底で
きていなかったこと等が原因であることが判明した。
様式 7-9頁
81