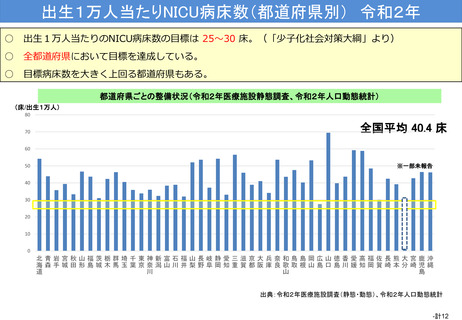
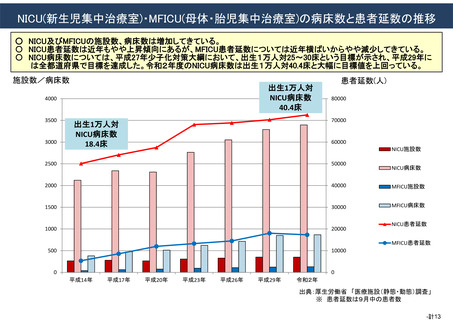
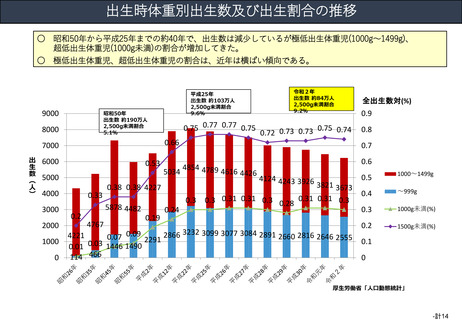
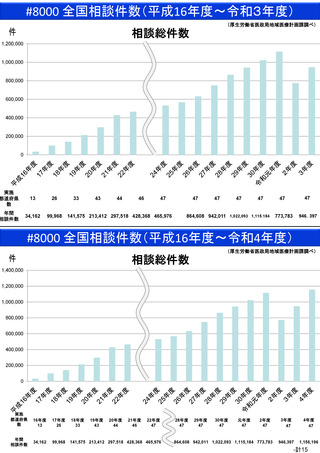
資料(Ⅱ)地域医療計画課 (68 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38529.html |
| 出典情報 | 令和5年度全国医政関係主管課長会議(3/29)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
医療上の有害事象に関する報告制度
1.医薬品・医療機器等安全性情報報告制度
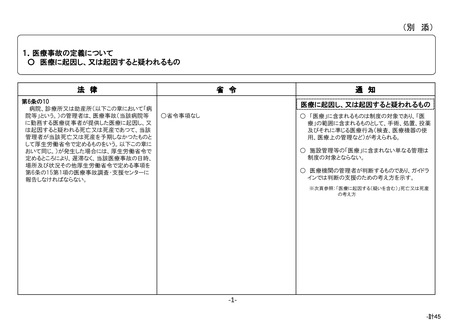
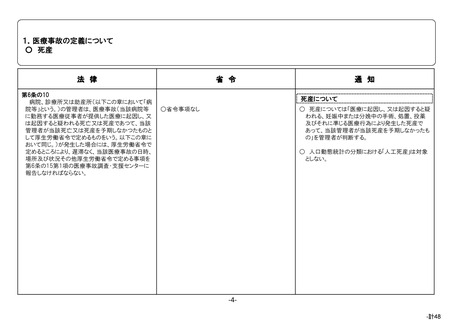
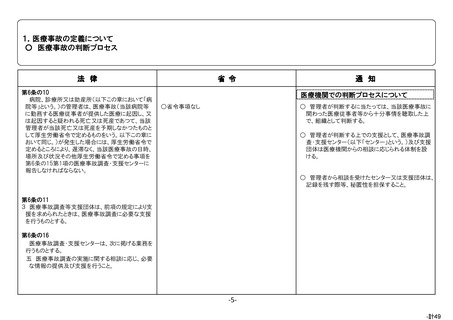
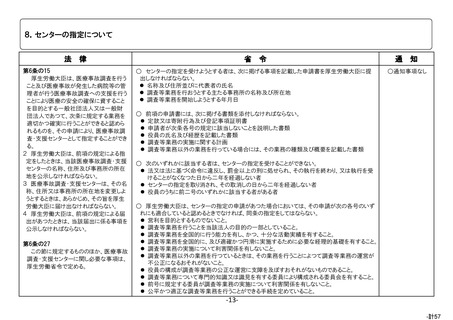
根拠
医薬品・医療機器等法第68条の 10 第2項
目的
医薬品、医療機器又は再生医療等製品の使用による副作用、感染症又
は不具合の発生(医療機器及び再生医療等製品の場合は、健康被害が発
生するおそれのある不具合も含む。)について、保健衛生上の危害の発生
又は拡大の防止。
報告者
医療関係者(薬局開設者、病院、診療所若しくは飼育動物診療施設の
開設者又は医師、歯科医師、薬剤師、登録販売者、獣医師その他の医薬
関係者)
報告する情報
医薬品、医療機器又は再生医療等製品の使用による副作用、感染症又
は不具合の発生(医療機器及び再生医療等製品の場合は、健康被害が発
生するおそれのある不具合も含む。)について、保健衛生上の危害の発生
又は拡大を防止する観点から報告の必要があると判断した情報(症例)
。
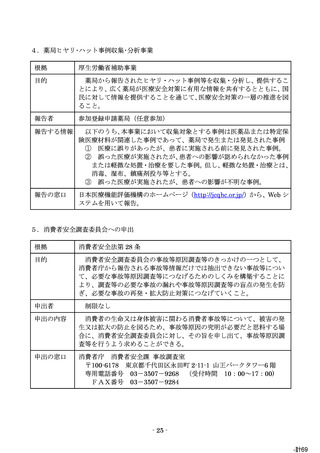
報告の窓口
独立行政法人 医薬品医療機器総合機構 安全第一部 情報管理課
〒100-0013 東京都千代田区霞が関 3-3-2 新霞が関ビル
FAX:0120-395-390
電子メール:anzensei-hokoku@pmda.go.jp
※ 郵送、FAX又は電子メールで受付
2.予防接種法に基づく副反応報告制度
根拠
予防接種法第 12 条第 1 項
目的
予防接種後に生じる種々の身体的反応や副反応について情報を収集
し、ワクチンの安全性について管理・検討を行い、以て広く国民に情報
を提供すること及び今後の予防接種行政の推進に資すること。
報告者
病院若しくは診療所の開設者又は医師
報告する情報
定期の予防接種等を受けた者が、当該定期の予防接種等を受けたこと
によるものと疑われる症状として厚生労働省令(注1)で定めるものを
呈している旨。
注1:予防接種法施行規則第 5 条に規定する症状
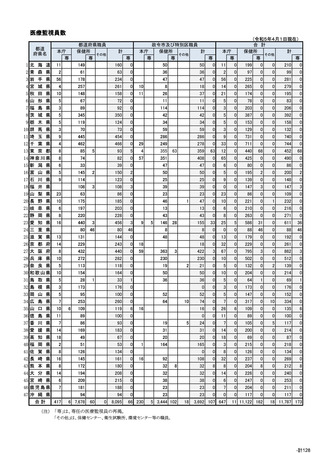
報告の窓口
独立行政法人医薬品医療機器総合機構 安全第一部情報管理課
〒100-0013 東京都千代田区霞が関 3-3-2 新霞が関ビル
FAX:0120-176-146
※ FAXのみの受付
- 23 Ⅱ-計67