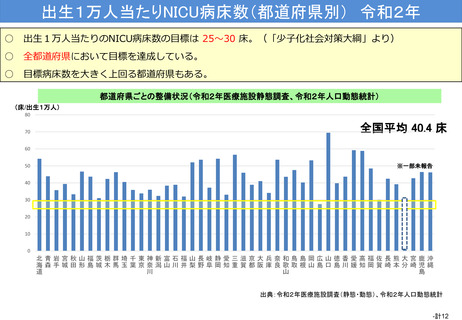
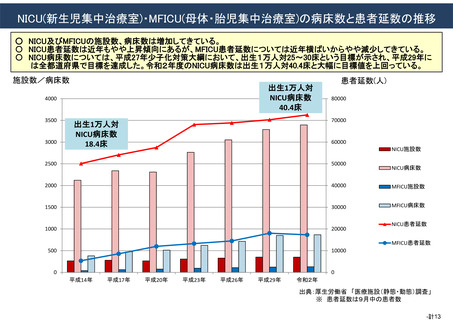
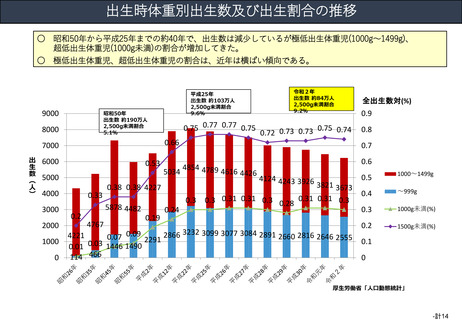
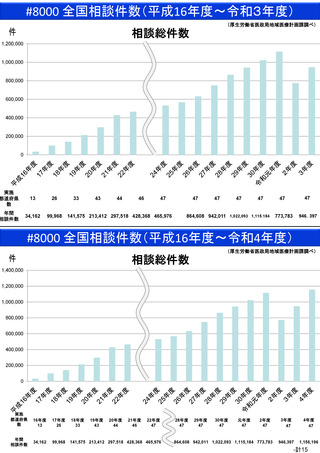
資料(Ⅱ)地域医療計画課 (81 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38529.html |
| 出典情報 | 令和5年度全国医政関係主管課長会議(3/29)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
レル単位をもって表わした数量に限られること。
なお、同条第1項第2号により届出されている数量等を超える量の診
(2)規則第24条第8号ハに掲げる診療用放射性同位元素又は陽電子断層撮
影診療用放射性同位元素の届出を行うに当たっては、次に掲げる事項に
留意すること。
療用放射線照射器具の使用を予定する場合には、同項第3号に規定する
ア ハ(1)に掲げるものについては、医薬品医療機器等法第80条の2
「放射線障害の防止に関する構造設備及び予防措置の概要」の変更に当
第2項に規定する治験の計画の届出の写し(受領印があり、厚生労働
たるので、あらかじめ規則第29条第2項による変更の届出が必要である
大臣又は独立行政法人医薬品医療機器総合機構によって受領されたこ
こと。
とが明らかであるもの)又は治験の依頼をしようとする者と締結した
(3)診療用放射線照射器具については、RI法の適用を受けるものであり、
RI法の規定を遵守しなければならないこと。
5 診療用放射性同位元素又は陽電子断層撮影診療用放射性同位元素の届出
(規則第28条)
医薬品の臨床試験の実施に関する省令(平成9年厚生省令第28号)第
13条の規定に基づく治験の契約の写し等、当該届出に係る診療用放射
性同位元素又は陽電子断層撮影診療用放射性同位元素が医薬品医療機
器等法第2条第17項に規定する治験に用いるものであることを証明で
(1)規則第28条の規定は、放射性同位元素による放射線障害を防止し公共
きる書面の添付が必要であること。
の安全の確保を図る観点から、規則第24条第8号に規定する陽電子断層
イ ハ(2)に掲げるものについては、臨床研究法第5条に規定する特
撮影診療用放射性同位元素又は同条第8号の2に規定する診療用放射性
定臨床研究の実施に関する計画の写し等、臨床研究法第2条第2項に
同位元素を病院又は診療所に備えようとする場合の手続を定めるもので
規定する特定臨床研究に用いるものであることを証明できる書面の添
あり、当該放射性医薬品を使用した患者の安全性を担保するものではな
いこと。
付が必要であること。
ウ ハ(3)に掲げるものについては、再生医療等法第4条に規定する
なお、規則第24条第8号イからニまでに掲げるものは、おおむね次に
再生医療等の研究に関する計画の写し等、再生医療等法第2条第1項
掲げるとおりであること。
に規定する再生医療等に用いるものであることを証明できる書面の添
ア イ及びロに掲げるものは、従前より医療法(昭和23年法律第205 号
付が必要であること。
)の規制対象である、病院又は診療所に存する放射性医薬品及び医薬
エ ハ(4)に掲げるものについては、当該届出を行う診療用放射性同
品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭
位元素又は陽電子断層撮影診療用放射性同位元素が先進医療又は患者
和35年法律第145 号。以下「医薬品医療機器等法」という。)の承認
申出療養に用いるものであることを証明できる書面として次に掲げる
又は認証を受けている医薬品又は体外診断用医薬品を指すものである
こと。
書面のいずれかの添付が必要であること。
(ア)先進医療については、「厚生労働大臣の定める先進医療及び施設
イ ハに掲げるものは、従前より医療法の規制対象である、病院又は診
基準の制定等に伴う実施上の留意事項の取扱いについて」(平成28
療所に存する医薬品医療機器等法に規定する治験に用いる薬物に加え
年3月4日付け医政発0304第2号・薬生発0304第2号・保発0304第
、人体に投与する目的で使用するに当たっての手続が明確であるもの
として、臨床研究法(平成29年法律第16号)第2条第2項に規定する
16号厚生労働省医政局長、医薬・生活衛生局長及び保険局長連名通
知)における先進医療実施届出書及び添付書類等の写し並びに地方
特定臨床研究に用いるもの、再生医療等の安全性の確保等に関する法
厚生(支)局が当該新規技術の適否について当該新規技術を実施す
律(平成25年法律第85号。以下「再生医療等法」という。)第2条第
る病院又は診療所に対して通知した書類の写し。
1項に規定する再生医療等に用いるもの及び厚生労働大臣の定める先
(イ)患者申出療養については、「健康保険法及び高齢者の医療の確保
進医療又は患者申出療養に用いるもののうち、病院又は診療所に存す
るものを指すものであること。
に関する法律に規定する患者申出療養の実施上の留意事項及び申出
等の取扱いについて」(平成28年3月4日付け医政発0304第3号・
ウ ニに掲げるものは、従前より医療法の規制対象である、病院又は診
薬生発0304第1号・保発0304第18号厚生労働省医政局長、医薬・生
療所に備えられたサイクロトロン装置等によって精製された放射性同
活衛生局長及び保険局長連名通知)に基づき作成された保険外併用
位元素から合成された陽電子断層撮影診療用放射性同位元素のうち、
病院又は診療所に存するものを指すものであること。
療養に係る厚生労働大臣が定める医薬品等(平成18年厚生労働省告
示第498号)11(1)に規定する申出書及び添付書類等の写し並びに
5
6
Ⅱ-計80