・資料No1-1~1-5_第十八改正日本薬局方第一追補(案) (60 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000174942_00007.html |
| 出典情報 | 薬事・食品衛生審議会 日本薬局方部会(令和4年度第1回 7/26)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
オキシブチニン塩酸塩
25 .
1
カラム:内径4.6 mm,長さ25 cmのステンレス管に3
46
ク面積を自動積分法により測定するとき,試料溶液のオキシ
2
μmの液体クロマトグラフィー用オクタデシルシリル
47
ブチニンに対する相対保持時間約1.6の類縁物質Aのピーク
3
化シリカゲルを充塡する.
48
面積は,標準溶液のオキシブチニンのピーク面積の3倍より
4
カラム温度:40℃付近の一定温度
49
大きくなく,試料溶液のオキシブチニン及び上記以外のピー
5
移動相:水/トリフルオロ酢酸混液(1000:1)
50
クの面積は,標準溶液のオキシブチニンのピーク面積の1/
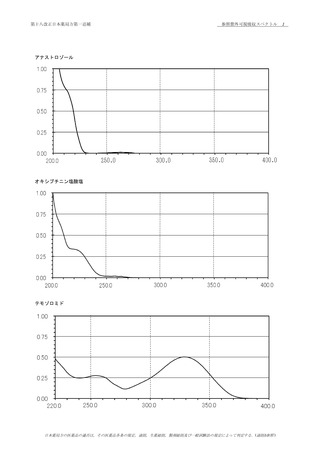
6
流量:ツベラクチノマイシンNの保持時間が約15分にな
51
5より大きくない.また,試料溶液のオキシブチニン及び類
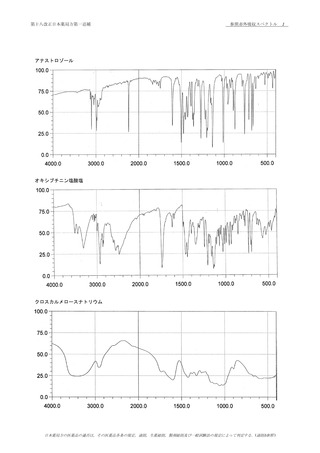
52
縁物質A以外のピークの合計面積は,標準溶液のオキシブチ
53
ニンのピーク面積より大きくない.ただし,類縁物質Aのピ
7
8
るように調整する.
システム適合性
9
システムの性能:試料溶液5 μLにつき,上記の条件で
54
ーク面積は自動積分法で求めた面積に感度係数2.3を乗じた
10
操作するとき,ツベラクチノマイシンN,ツベラクチ
55
値とする.
11
ノマイシンOの順に溶出し,その分離度は3以上であ
56
試験条件
12
る.
57
検出器:紫外吸光光度計(測定波長:210 nm)
13
システムの再現性:試料溶液5 μLにつき,上記の条件
58
カラム:内径3.9 mm,長さ15 cmのステンレス管に5
14
で試験を6回繰り返すとき,ツベラクチノマイシンN
59
μmの液体クロマトグラフィー用オクチルシリル化シ
15
のピーク面積の相対標準偏差は2.0%以下である.
60
16
リカゲルを充塡する.
61
カラム温度:25℃付近の一定温度
62
移動相:リン酸二水素カリウム3.4 g及びリン酸水素二
医薬品各条の部 オキシドールの条の次に次の一条を加える. 63
カリウム4.36 gを水に溶かし,1000 mLとする.この
64
液490 mLに液体クロマトグラフィー用アセトニトリ
17
オキシブチニン塩酸塩
18
Oxybutynin Hydrochloride
65
ル510 mLを加える.
66
流量:オキシブチニンの保持時間が約15分になるよう
67
に調整する.
68
面積測定範囲:オキシブチニンの保持時間の約2倍の範
69
70
19
囲
システム適合性
71
検出の確認:標準溶液2 mLを正確に量り,移動相を加
72
えて正確に20 mLとする.この液10 μLから得たオキ
20
C22H31NO3・HCl:393.95
73
シブチニンのピーク面積が,標準溶液のオキシブチニ
21
4-(Diethylamino)but-2-yn-1-yl (2RS)-2-cyclohexyl-2-hydroxy-
74
ンのピーク面積の7 ~ 13%になることを確認する.
22
2-phenylacetate monohydrochloride
75
システムの性能:標準溶液10 μLにつき,上記の条件で
23
[1508-65-2]
76
操作するとき,オキシブチニンのピークの理論段数及
77
びシンメトリー係数は,それぞれ5000段以上,1.5以
24
25
26
本品を乾燥したものは定量するとき,オキシブチニン塩酸
塩(C22H31NO3・HCl) 98.0 ~ 101.0%を含む.
性状 本品は白色の結晶性の粉末である.
78
下である.
79
システムの再現性:標準溶液10 μLにつき,上記の条件
80
で試験を6回繰り返すとき,オキシブチニンのピーク
27
本品は水又はエタノール(99.5)に溶けやすい.
81
28
本品の水溶液(1→50)は旋光性を示さない.
82
乾燥減量〈2.41〉
3.0%以下(0.5 g,105℃,4時間).
83
強熱残分〈2.44〉
0.1%以下(1 g).
定量法
面積の相対標準偏差は2.0%以下である.
29
確認試験
30
(1)
本品の水溶液(3→100000)につき,紫外可視吸光度測
84
31
定法〈2.24〉により吸収スペクトルを測定し,本品のスペク
85
/酢酸(100)混液(7:3) 70 mLに溶かし,0.1 mol/L過塩素酸
32
トルと本品の参照スペクトルを比較するとき,両者のスペク
86
で滴定〈2.50〉する(電位差滴定法).同様の方法で空試験を行
33
トルは同一波長のところに同様の強度の吸収を認める.
87
い,補正する.
34
(2)
35
塩化カリウム錠剤法により試験を行い,本品のスペクトルと
88
0.1 mol/L過塩素酸1 mL=39.40 mg C22H31NO3・HCl
36
本品の参照スペクトルを比較するとき,両者のスペクトルは
89
37
同一波数のところに同様の強度の吸収を認める.
90
保存条件 遮光して保存する.
38
(3)
91
容器 気密容器.
39
する.
40
融点〈2.60〉
41
本品を乾燥し,その約0.5 gを精密に量り,無水酢酸
本品を乾燥し,赤外吸収スペクトル測定法 〈2.25〉の
本品の水溶液(1→50)は塩化物の定性反応〈1.09〉を呈
92
124 ~ 129℃
貯法
その他
93
類縁物質A:
純度試験 類縁物質 本品50 mgを移動相10 mLに溶かし,試
94
4-(Diethylamino)but-2-yn-1-yl (2R)-2-(cyclohex-
42
料溶液とする.この液1 mLを正確に量り,移動相を加えて
95
3-en-1-yl)-2-cyclohexyl-2-hydroxyacetate
43
正確に200 mLとし,標準溶液とする.試料溶液及び標準溶
44
液10 μLずつを正確にとり,次の条件で液体クロマトグラフ
45
ィー〈2.01〉により試験を行う.それぞれの液の各々のピー
日本薬局方の医薬品の適否は,その医薬品各条の規定,通則,生薬総則,製剤総則及び一般試験法の規定によって判定する. (通則5参照 )