・資料No1-1~1-5_第十八改正日本薬局方第一追補(案) (69 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000174942_00007.html |
| 出典情報 | 薬事・食品衛生審議会 日本薬局方部会(令和4年度第1回 7/26)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第十八改正日本薬局方第一追補
1
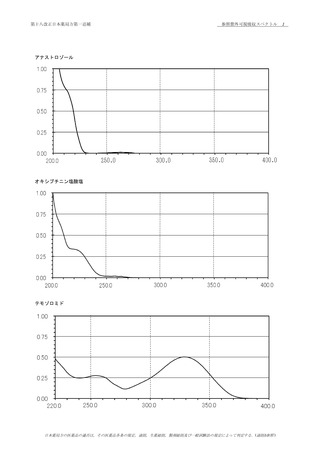
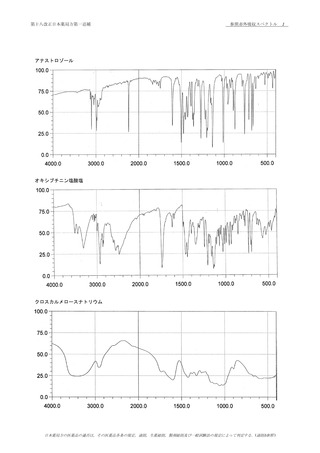
臭化カリウム錠剤法により試験を行い,本品のスペクトルと
55
強熱残分〈2.44〉
2
本品の参照スペクトル又はパラオキシ安息香酸エチル標準品
56
定量法 本品及びパラオキシ安息香酸エチル標準品約50 mgず
3
のスペクトルを比較するとき,両者のスペクトルは同一波数
57
つを精密に量り,それぞれメタノール2.5 mLに溶かし,移
4
のところに同様の強度の吸収を認める.
58
動相を加えて正確に50 mLとする.それぞれの液10 mLを正
59
確に量り,それぞれに移動相を加えて正確に100 mLとし,
5
融点〈2.60〉
6
純度試験
115 ~ 118℃
0.1%以下(1 g).
60
試料溶液及び標準溶液とする.試料溶液及び標準溶液10 μL
7
(1) 溶状 本品1.0 gをエタノール(95)に溶かして10 mLと
61
ずつを正確にとり,次の条件で液体クロマトグラフィー
8
するとき,液は澄明で,液の色はエタノール(95)又は次の比
62
〈2.01〉 により試験を行い,それぞれの液のパラオキシ安息
9
較液より濃くない.
63
香酸エチルのピーク面積AT及びA Sを測定する.
64
パラオキシ安息香酸エチル(C9H10O3)の量(mg)
10
比較液:塩化コバルト(Ⅱ)の色の比較原液5.0 mL,塩化鉄
11
(Ⅲ)の色の比較原液12.0 mL及び硫酸銅(Ⅱ)の色の比較
12
原液2.0 mLをとり,薄めた希塩酸(1→10)を加えて1000
13
mLとする.
14
(2)
15
新たに煮沸して冷却した水5 mL及びブロモクレゾールグリ
16
ーン・水酸化ナトリウム・エタノール試液0.1 mLを加える.
17
この液に液の色が青色に変化するまで0.1 mol/L水酸化ナト
18
リウム液を加えるとき,その量は0.1 mL以下である.
19
(3) 類縁物質 本品50.0 mgをメタノール2.5 mLに溶かし
20
た後,移動相を加えて正確に50 mLとする.この液10 mLを
21
正確に量り,移動相を加えて正確に100 mLとし,試料溶液
22
とする.この液1 mLを正確に量り,移動相を加えて正確に
23
20 mLとする.この液1 mLを正確に量り,移動相を加えて
24
正確に10 mLとし,標準溶液とする.試料溶液及び標準溶液
25
10 μLずつを正確にとり,次の条件で液体クロマトグラフィ
26
ー 〈2.01〉により試験を行う.それぞれの液の各々のピーク
27
面積を自動積分法により測定するとき,試料溶液のパラオキ
28
シ安息香酸エチルに対する相対保持時間約0.5のパラオキシ
29
安息香酸のピーク面積は,標準溶液のパラオキシ安息香酸エ
30
チルのピーク面積より大きくない(0.5%).ただし,パラオ
31
キシ安息香酸のピーク面積は自動積分法により求めた面積に
32
感度係数1.4を乗じた値とする.また,試料溶液のパラオキ
33
シ安息香酸エチル及びパラオキシ安息香酸以外のピークの面
34
積は,標準溶液のパラオキシ安息香酸エチルのピーク面積よ
35
り大きくない(0.5%).また,試料溶液のパラオキシ安息香
36
酸エチル以外のピークの合計面積は,標準溶液のパラオキシ
37
安息香酸エチルのピーク面積の2倍より大きくない(1.0%).
38
ただし,標準溶液のパラオキシ安息香酸エチルのピーク面積
39
の1/5以下のピークは計算しない(0.1%).
40
41
酸
検出器,カラム,カラム温度,移動相及び流量は定量法
の試験条件を準用する.
面積測定範囲:パラオキシ安息香酸エチルの保持時間の
44
45
4倍の範囲
システム適合性
46
システムの性能は定量法のシステム適合性を準用する.
47
◇
66
MS:パラオキシ安息香酸エチル標準品の秤取量(mg)
67
試験条件
68
検出器:紫外吸光光度計(測定波長:272 nm)
69
カラム:内径4.6 mm,長さ15 cmのステンレス管に5
70
μmの液体クロマトグラフィー用オクタデシルシリル
71
化シリカゲルを充塡する.
72
◇
73
移動相:メタノール/リン酸二水素カリウム溶液(17→
カラム温度:35℃付近の一定温度◇
74
2500)混液(13:7)
75
流量:毎分1.3 mL
76
システム適合性
77
システムの性能:本品,パラオキシ安息香酸メチル及び
78
パラオキシ安息香酸それぞれ5 mgを移動相に溶かし,
79
正確に100 mLとする.この液1 mLを正確に量り,移
80
動相を加えて正確に10 mLとした液10 μLにつき,上
81
記の条件で操作するとき,パラオキシ安息香酸,パラ
82
オキシ安息香酸メチル,パラオキシ安息香酸エチルの
83
順に溶出し,パラオキシ安息香酸エチルに対するパラ
84
オキシ安息香酸及びパラオキシ安息香酸メチルの相対
85
保持時間は約0.5及び約0.8であり,パラオキシ安息香
86
酸メチルとパラオキシ安息香酸エチルの分離度は2.0
87
以上である.
88
システムの再現性:標準溶液10 μLにつき,上記の条件
89
で試験を6回繰り返すとき,パラオキシ安息香酸エチ
90
91
ルのピーク面積の相対標準偏差は0.85%以下である.
◆
貯法 容器 密閉容器.◆
加えて正確に10 mLとする.この液10 μLから得たパ
49
ラオキシ安息香酸エチルのピーク面積が,標準溶液の
50
パラオキシ安息香酸エチルのピーク面積の14 ~ 26%
51
になることを確認する.◇
◇
92
医薬品各条の部 パラオキシ安息香酸ブチルの条を次のよう
93
に改める.
94
パラオキシ安息香酸ブチル
95
Butyl Parahydroxybenzoate
検出の確認:標準溶液2 mLを正確に量り,移動相を
48
52
=MS × AT/A S
試験条件
42
43
(1)の液2 mLにエタノール(95) 3 mLを加えた後,
65
システムの再現性:標準溶液10 μLにつき,上記の条
53
件で試験を6回繰り返すとき,パラオキシ安息香酸エ
54
チルのピーク面積の相対標準偏差は2.0%以下である.◇
96
97
C11H14O3:194.23
98
Butyl 4-hydroxybenzoate
99
[94-26-8]
日本薬局方の医薬品の適否は,その医薬品各条の規定,通則,生薬総則,製剤総則及び一般試験法の規定によって判定する. (通則5参照 )