・資料No1-1~1-5_第十八改正日本薬局方第一追補(案) (75 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000174942_00007.html |
| 出典情報 | 薬事・食品衛生審議会 日本薬局方部会(令和4年度第1回 7/26)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第十八改正日本薬局方第一追補
1
ブデソニド
48
2
Budesonide
49
50
51
52
53
フ ィ ー 用 ア セ ト ニ ト リ ル / エ タ ノ ー ル (99.5) 混 液
(34:16:1)
移動相B:pH 3.2のリン酸塩緩衝液/液体クロマトグラ
フィー用アセトニトリル混液(1:1)
移動相の送液:移動相A及び移動相Bの混合比を次のよ
うに変えて濃度勾配制御する.
注入後の時間
(分)
3
4
C25H34O6:430.53
5
16α,17-[(1RS)-Butylidenebis(oxy)]-11β,21-dihydroxypregna-1,4-
6
diene-3,20-dione
7
[51333-22-3]
0 ~ 38
38 ~ 50
50 ~ 60
54
55
8
本品は定量するとき,換算した乾燥物に対し,ブデソニド
移動相A
(vol%)
100
100 → 0
0
移動相B
(vol%)
0
0 → 100
100
面積測定範囲:溶媒のピークの後から注入後60分まで
システム適合性
56
検出の確認:試料溶液1 mLを正確に量り,pH 3.2のリ
57
ン酸塩緩衝液/アセトニトリル混液(17:8)を加えて
本品は白色~微黄白色の結晶又は結晶性の粉末である.
58
正確に10 mLとする.この液1 mLを正確に量り,pH
11
本品はメタノールにやや溶けやすく,アセトニトリル又は
59
3.2のリン酸塩緩衝液/アセトニトリル混液(17:8)を
12
エタノール(99.5)にやや溶けにくく,水にほとんど溶けない.
60
加えて正確に100 mLとし,システム適合性試験用溶
61
液とする.システム適合性試験用溶液20 μLにつき,
62
上記の条件で操作するとき,ブデソニドの二つのピー
63
クのうち後に溶出するピーク(エピマーA)のSN比は10
9
10
13
14
15
(C25H34O6) 98.0 ~ 102.0%を含む.
性状
旋光度
〔α〕25
:+102 ~ +109° (0.25 g,メタノール,
D
25 mL,100 mm).
融点:約240℃(分解).
16
確認試験
17
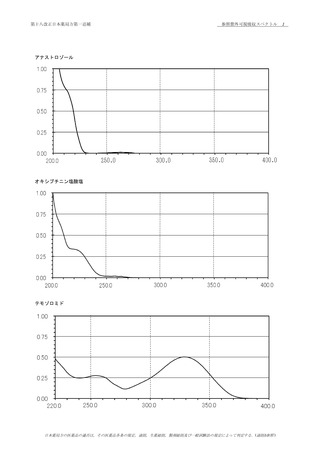
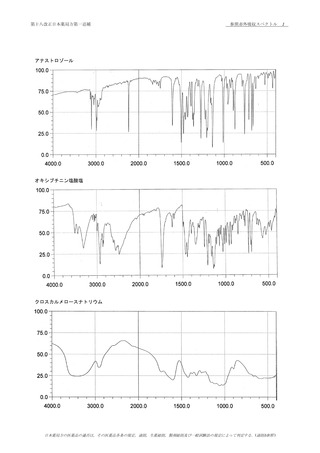
(1)
本品のメタノール溶液(1→40000)につき,紫外可視
65
システムの性能:システム適合性試験用溶液20 μLにつ
18
吸光度測定法 〈2.24〉により吸収スペクトルを測定し,本品
66
き,上記の条件で操作するとき,ブデソニドの二つの
19
のスペクトルと本品の参照スペクトル又はブデソニド標準品
67
20
21
について同様に操作して得られたスペクトルを比較するとき, 68
両者のスペクトルは同一波長のところに同様の強度の吸収を
69
22
認める.
70
量法の試料溶液20 μLにつき,次の条件で液体クロマトグラ
23
(2)
本品につき,赤外吸収スペクトル測定法 〈2.25〉の臭
71
フィー〈2.01〉により試験を行う.ブデソニドの二つのピー
24
化カリウム錠剤法により試験を行い,本品のスペクトルと本
72
クのうち,先に溶出するピーク面積 Ab及び後に溶出するピ
25
品の参照スペクトル又はブデソニド標準品のスペクトルを比
73
ーク面積Aaを測定するとき,Aa/(Aa + Ab)は0.40 ~ 0.51で
26
較するとき,両者のスペクトルは同一波数のところに同様の
74
ある.
27
強度の吸収を認める.
75
64
以上である.
ピークの分離度は1.5以上である.
乾燥減量〈2.41〉
0.5%以下(1 g,105℃,3時間).
異性体比 本操作は光を避け,遮光した容器を用いて行う.定
試験条件
28
純度試験 類縁物質 本操作は光を避け,遮光した容器を用い
76
29
て行う.本品50 mgをアセトニトリル15 mLに溶かし,pH
77
30
31
3.2のリン酸塩緩衝液を加えて50 mLとし,試料溶液とする. 78
試料溶液20 μLにつき,次の条件で液体クロマトグラフィー
79
32
〈2.01〉 により試験を行う.試料溶液の各々のピーク面積を
80
及びブデソニド標準品(別途本品と同様の条件で乾燥減量
33
自動積分法により測定し,面積百分率法によりそれらの量を
81
〈2.41〉を測定しておく)約25 mgずつを精密に量り,それぞ
34
求めるとき,ブデソニドの二つのピークのうち,先に溶出す
82
れをアセトニトリル15 mLに溶かし,pH 3.2のリン酸塩緩
35
るピーク(エピマーB)に対する相対保持時間約0.1及び約0.95
83
衝液を加えて正確に50 mLとし,試料溶液及び標準溶液とす
36
の類縁物質A及び類縁物質Lのピークの量はそれぞれ0.2%以
84
る.試料溶液及び標準溶液20 μLずつを正確にとり,次の条
37
下,相対保持時間約0.63及び約0.67の類縁物質Dのピークの
85
件で液体クロマトグラフィー 〈2.01〉により試験を行い,そ
38
量の和,並びに相対保持時間約2.9及び約3.0の類縁物質Kの
86
れぞれの液のブデソニドの二つのピーク面積の和 AT及び AS
39
ピークの量の和は,それぞれ0.2%以下であり,ブデソニド
87
を測定する.
40
及び上記以外のピークの量は0.1%以下である.また,ブデ
41
ソニド以外のピークの合計量は0.5%以下である.ただし,
88
ブデソニド(C25H34O6)の量(mg)=MS × AT/AS
42
類縁物質D及び類縁物質Kのピーク面積は自動積分法で求め
43
た面積にそれぞれ感度係数1.8及び1.3を乗じた値とする.
44
45
46
47
試験条件
検出器,カラム,カラム温度及び流量は定量法の試験条
件を準用する.
移動相A:pH 3.2のリン酸塩緩衝液/液体クロマトグラ
定量法の試験条件を準用する.
システム適合性
システムの性能は定量法のシステムの性能を準用する.
定量法 本操作は光を避け,遮光した容器を用いて行う.本品
89
MS:乾燥物に換算したブデソニド標準品の秤取量(mg)
90
試験条件
91
検出器:紫外吸光光度計(測定波長:240 nm)
92
カラム:内径4.6 mm,長さ15 cmのステンレス管に3
93
μmの液体クロマトグラフィー用オクタデシルシリル
94
化シリカゲルを充塡する.
日本薬局方の医薬品の適否は,その医薬品各条の規定,通則,生薬総則,製剤総則及び一般試験法の規定によって判定する. (通則5参照 )