・資料No1-1~1-5_第十八改正日本薬局方第一追補(案) (64 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000174942_00007.html |
| 出典情報 | 薬事・食品衛生審議会 日本薬局方部会(令和4年度第1回 7/26)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第十八改正日本薬局方第一追補
1
〈2.50〉する.同様の方法で空試験を行う.
2
0.1 mol/Lエチレンジアミン四酢酸二水素二ナトリウム液
3
1 mL
4
5
=2.431 mg Mg
◆
貯法
6
7
8
容器 気密容器.◆
医薬品各条の部 注射用スペクチノマイシン塩酸塩の条製剤
均一性の項を次のように改める.
注射用スペクチノマイシン塩酸塩
9
製剤均一性 〈6.02〉
10
別に規定する).
11
12
13
14
質量偏差試験を行うとき,適合する(T:
医薬品各条の部 注射用セフォペラゾンナトリウム・スルバ
クタムナトリウムの条製剤均一性の項を次のように改める.
注射用セフォペラゾンナトリウム・スル
バクタムナトリウム
15
製剤均一性 〈6.02〉
16
別に規定する).
17
質量偏差試験を行うとき,適合する(T:
医薬品各条の部 粉末セルロースの条を次のように改める.
18
粉末セルロース
19
Powdered Cellulose
20
[9004-34-6,セルロース]
38
溶かし,ヨウ素0.5 gを加えて15分間振り混ぜる.この液2
39
mL中に本品約10 mgを時計皿上で分散するとき,分散物は
40
青紫色を呈する.
41
◇
42
高速度(毎分18000回転以上)で5分間かき混ぜた後,その100
43
mLを100 mLのメスシリンダーに入れ,1時間放置するとき,
44
液は分離し,上澄液と沈殿を生じる.◇
45
(3)
46
に入れ,水25 mL及び1 mol/L銅エチレンジアミン試液25
47
mLをそれぞれ正確に加える.以下「結晶セルロース」の確
48
認試験(3)を準用して試験を行うとき,平均重合度P は440よ
49
り大きく,◆かつ表示範囲内である.◆
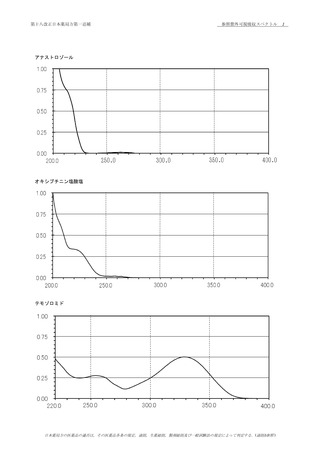
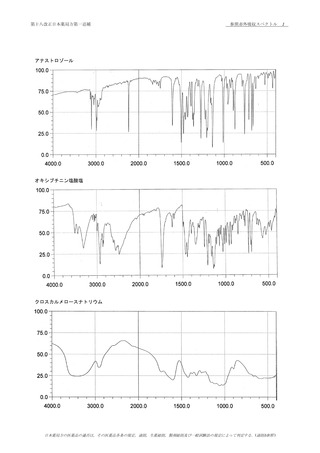
50
本医薬品各条は,三薬局方での調和合意に基づき規定した医薬品
22
本品30 gに水270 mLを加え,かき混ぜ機を用いて
本品約0.25 gを精密に量り,125 mLの三角フラスコ
pH〈2.54〉
51
本品10 gに水90 mLを加え,時々振り混ぜなが
ら,1時間放置するとき,上澄液のpHは5.0 ~ 7.5である.
52
純度試験
53
(1)
54
mLを加え,10分間時々振り混ぜた後,ろ紙を用いて吸引ろ
55
過し,初めのろ液10 mLを除き,次のろ液を必要ならば再び
56
同じろ紙を用いて吸引ろ過し,澄明なろ液15.0 mLを質量既
57
知の蒸発皿にとる.内容物を焦がさないように蒸発乾固し,
58
残留物を105℃で1時間乾燥し,デシケーター中で放冷した
59
後,質量を量るとき,その量は15.0 mg以下である(1.5%).
60
同様の方法で空試験を行い,補正する.
61
(2) ジエチルエーテル可溶物 本品10.0 gを内径約20 mm
62
のクロマトグラフィー管に入れ,過酸化物を含まないジエチ
63
ルエーテル50 mLをこのカラムに流す.溶出液をあらかじめ
64
乾燥した質量既知の蒸発皿中で蒸発乾固する.残留物を
65
105℃で30分間乾燥し,デシケーター中で放冷した後,質量
66
を量るとき,残留物は15.0 mg以下である(0.15%).同様の
67
方法で空試験を行い,補正する.
本品6.0 gに新たに煮沸して冷却した水90
水可溶物
68
乾燥減量〈2.41〉
6.5%以下(1 g,105℃,3時間).
69
強熱残分〈2.44〉
0.3%以下(1 g,乾燥物換算).
70
◆
微生物限度〈4.05〉
容基準は103 CFU,総真菌数の許容基準は102 CFUである.
72
また,大腸菌,サルモネラ,緑膿菌及び黄色ブドウ球菌を認
74
めない.◆
◆
貯法 容器 気密容器.◆
各条である.
23
なお,三薬局方で調和されていない部分のうち,調和合意におい
24
て,調和の対象とされた項中非調和となっている項の該当箇所は
75
25
「◆
76
を加える.
26
することとした項は「
77
テモゾロミド
78
Temozolomide
27
◆
」で,調和の対象とされた項以外に日本薬局方が独自に規定
◇
◇
」で囲むことにより示す.
三薬局方の調和合意に関する情報については,独立行政法人医薬
28
品医療機器総合機構のウェブサイトに掲載している.
29
本品は繊維性植物からパルプとして得た α-セルロース
30
を, 必要に応じて,部分的加水分解などの ◇処理を行った
31
後,精製し,機械的に粉砕したものである.
34
35
36
37
医薬品各条の部 テモカプリル塩酸塩錠の条の次に次の三条
◇
◆
32
33
本品1 g当たり,総好気性微生物数の許
71
73
21
(2)
本品には平均重合度を範囲で表示する.◆
◆
性状
本品は白色の粉末である.
79
本品は水,エタノール(95)又はジエチルエーテルにほとん
ど溶けない.◆
確認試験
(1) 塩化亜鉛20 g及びヨウ化カリウム6.5 gを水10.5 mLに
日本薬局方の医薬品の適否は,その医薬品各条の規定,通則,生薬総則,製剤総則及び一般試験法の規定によって判定する. (通則5参照 )