・資料No1-1~1-5_第十八改正日本薬局方第一追補(案) (68 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000174942_00007.html |
| 出典情報 | 薬事・食品衛生審議会 日本薬局方部会(令和4年度第1回 7/26)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第十八改正日本薬局方第一追補
1
システム適合性
46
緑色に変わるときとする.同様の方法で空試験を行う.ただ
2
シ ス テム の性 能: テモ ゾ ロミド 1 mgに 移 動 相/ 0.1
47
し,漏斗から加える水酸化ナトリウム溶液(21→50)は,フラ
3
mol/L塩酸試液混液(1:1)を加えて10 mLとし,80℃
48
スコ内の液が帯青緑色から暗褐色又は黒色に変わるのに十分
4
で約4時間加熱した後,約4℃に冷却する.この液に
49
な量とする.
5
移動相を加えて25 mLとする.この液75 μLにつき,
6
上記の条件で操作するとき,テモゾロミドと類縁物質
50
窒素の量(%)=(a - b) × 0.035/M
7
IAの分離度は2.5以上であり,テモゾロミドのピーク
51
M:本品の秤取量(g)
8
のシンメトリー係数は1.9以下である.
52
a:空試験における0.025 mol/L水酸化ナトリウム液の消費
9
システムの再現性:標準溶液75 μLにつき,上記の条件
53
で試験を6回繰り返すとき,テモゾロミドのピーク面
54
積の相対標準偏差は1.0%以下である.
55
10
11
12
量(mL)
b:本品の試験における0.025 mol/L水酸化ナトリウム液の
消費量(mL)
56
貯法
13
保存条件 2 ~ 8℃で保存する.
14
容器
15
その他
総タンパク質は0.3%[窒素(N:14.01)として0.048%(窒素
57
からタンパク質への換算係数は6.25を用いる)]以下である.
密封容器.
16
類縁物質Eは「テモゾロミド」のその他を準用する.
58
17
類縁物質IA:
59
18
5-Amino-1H-imidazole-4-carboxamide
医薬品各条の部 ナルトグラスチム(遺伝子組換え)の条を削
る.
60
61
医薬品各条の部 注射用ナルトグラスチム(遺伝子組換え)の
条を削る.
19
62
20
21
医薬品各条の部 コムギデンプンの条純度試験の項(5)の
医薬品各条の部 パラオキシ安息香酸エチルの条を次のよう
63
に改める.
64
パラオキシ安息香酸エチル
65
Ethyl Parahydroxybenzoate
目を次のように改める.
22
コムギデンプン
23
純度試験
24
(5)
25
フラスコに入れ,分解促進剤(硫酸カリウム100 g,硫酸銅
26
(Ⅱ)五水和物3 g及び酸化チタン(Ⅳ) 3 gの混合物を粉末とし
27
たもの) 4 gを加え,フラスコの首に付着した試料を少量の水
28
29
で洗い込み,更にフラスコの内壁に沿って硫酸25 mLを加え, 68
69
振り混ぜる.フラスコを初め徐々に加熱し,次にフラスコの
30
首で硫酸が液化する程度にフラスコの上部が過熱しないよう
31
注意しながら昇温する.このとき硫酸の過剰な消失を防ぐた
32
70
め,例えば,フラスコの口を1本の短い枝が付いたガラス球
33
71
などを用いて緩く蓋をする.液が澄明となり,フラスコの内
34
72
なお,三薬局方で調和されていない部分のうち,調和合意におい
壁に炭化物を認めなくなったとき,加熱をやめる.冷後,水
35
25 mLを注意しながら加えて固形物を溶かし,再び冷却する.
73
て,調和の対象とされた項中非調和となっている項の該当箇所は
36
74
「◆
フラスコを,あらかじめ水蒸気を通じて洗った蒸留装置に連
37
結する.受器には0.01 mol/L塩酸25 mLを正確に量り,適量
75
することとした項は「
38
の水を加え,冷却器の下端をこの液に浸す.漏斗から空試験
39
と同量の水酸化ナトリウム溶液(21→50)を加え,直ちにピン
40
チコック付きゴム管のピンチコックを閉じ,水蒸気を通じて
78
41
留液約40 mLを得るまで蒸留する.冷却器の下端を液面から
79
42
離し,更にしばらく蒸留を続けた後,少量の水でその部分を
80
43
洗い込み,過量の塩酸を0.025 mol/L水酸化ナトリウム液で
81
44
滴定〈2.50〉する(指示薬:メチルレッド・メチレンブルー試
82
45
液3滴).このとき,滴定の終点は液の赤紫色が灰青色を経て, 83
総タンパク質
本品約3 gを精密に量り,ケルダール
66
67
C9H10O3:166.17
Ethyl 4-hydroxybenzoate
[120-47-8]
本医薬品各条は,三薬局方での調和合意に基づき規定した医薬品
各条である.
76
◆
」で,調和の対象とされた項以外に日本薬局方が独自に規定
◇
◇
」で囲むことにより示す.
三薬局方の調和合意に関する情報については,独立行政法人医薬
77
品医療機器総合機構のウェブサイトに掲載している.
本品は定量するとき,パラオキシ安息香酸エチル
(C9H10O3) 98.0 ~ 102.0%を含む.
◆
性状 本品は無色の結晶又は白色の結晶性の粉末である.
本品はメタノール,エタノール(95)又はアセトンに溶けや
すく,水に極めて溶けにくい.◆
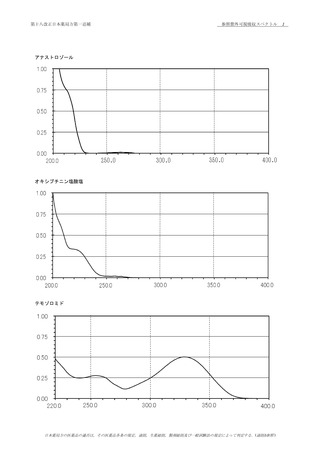
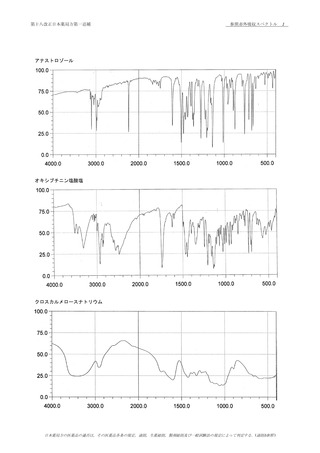
確認試験
本品につき,赤外吸収スペクトル測定法 〈2.25〉の
日本薬局方の医薬品の適否は,その医薬品各条の規定,通則,生薬総則,製剤総則及び一般試験法の規定によって判定する. (通則5参照 )