よむ、つかう、まなぶ。
資料1-2 令和5年度研究事業実施方針(案)の概要【AMED研究】 (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26761.html |
| 出典情報 | 厚生科学審議会科学技術部会(第130回 7/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
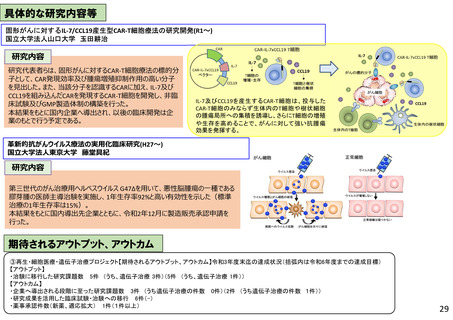
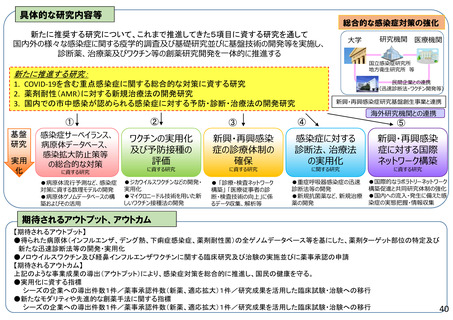
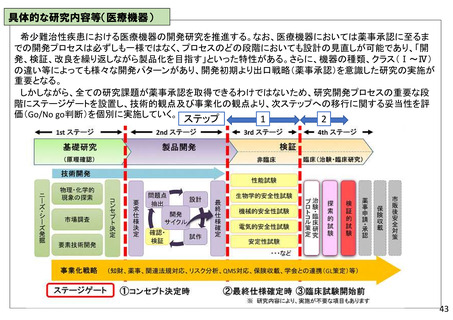
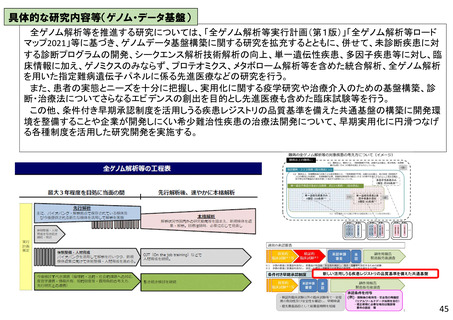
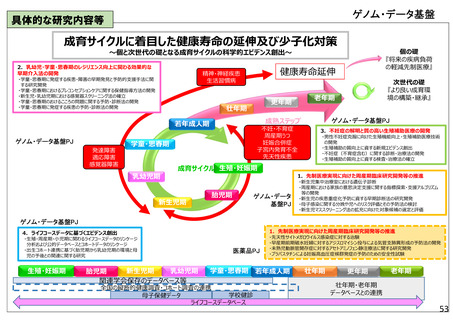
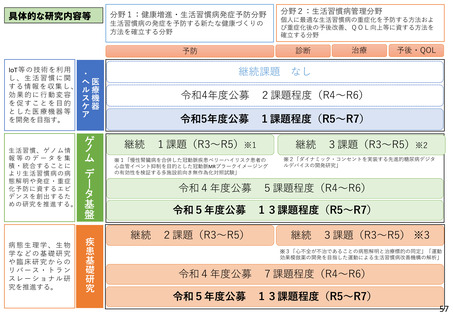
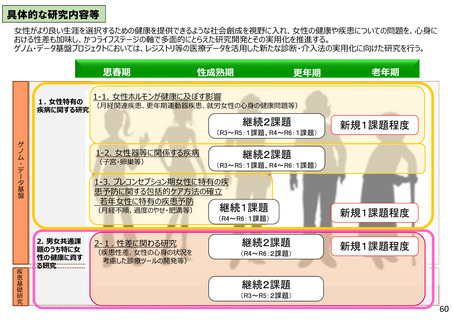
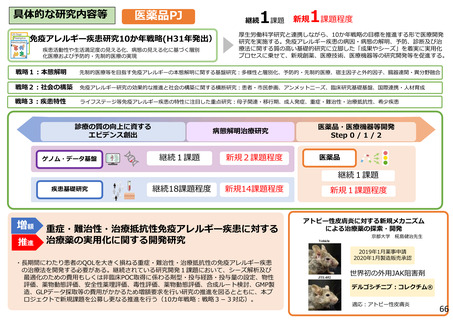
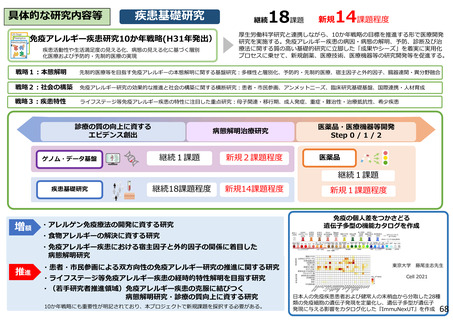
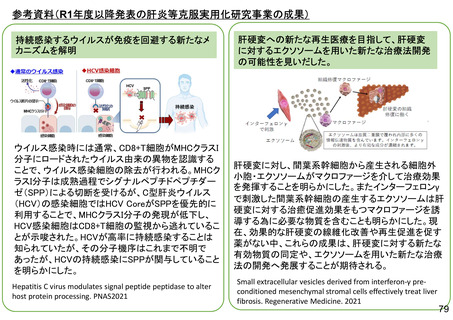
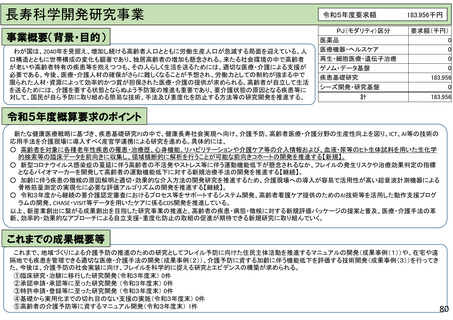
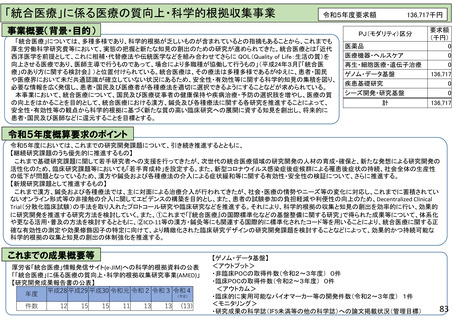
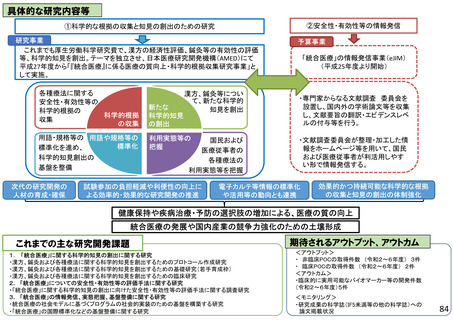
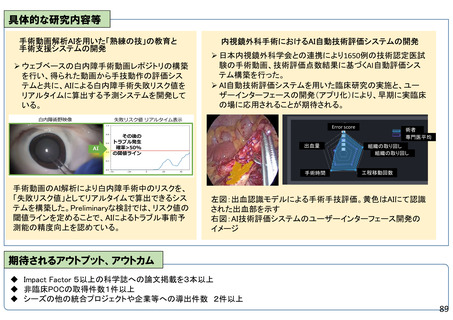
具体的な研究内容等
課題・背景
• 「医療分野研究開発推進計画 (第2期) 」では、「医療現場のニーズに応える医薬品の実用化」のため、モダリ
ティの特徴や性質を考慮した研究開発を行うことが求められている。具体的には、各モダリティのデザイン、最適化、
活性評価、有効性・安全性評価手法、製造技術等の開発を行う、とされている。
• ガイドラインの国際協調を図ることは、グローバルな医薬品承認のタイムラグを最小化する上で極めて重要な要因
であり、日本が主導して評価法を開発し、国際動向をリードする必要がある。
• 高品質な医薬品等の安定供給のため、各種先進技術の医薬品等製造・管理技術の開発が期待されている。
令和5年度研究の概要
研究の成果・活用
新規公募課題を大きく3つのテーマにまとめる。公募研究の例を示す。
• 新規医薬品等の開発の環境整備に資する研究
遺伝子改変動物由来の臓器・組織を実用化するにあたって、品質・安全性を確保するための
技術的課題や評価要件、規制要件等を整理し、海外の規制の動向も踏まえ、遺伝子改変動
物由来の臓器・組織の品質・安全性に関するガイドライン案を作成する。
医薬品等に係る薬事規制の国際調和に資する研究
放射性医薬品の品質試験に求められる要件(試験精度、試験数、実施時期など)について、
最新の科学的知見や国際薬事規制を踏まえた見直し案を提案する。また、革新的放射線治
療機器の承認迅速化と早期普及を目指した次世代国際標準評価法の開発を行う。
• 医薬品等の品質、有効性、安全性等の評価、分析法等の開発に資する研究
ナノ粒子製剤に用いられる高機能性添加剤の開発状況や最新の分析技術を調査するとともに、
脂質ナノ粒子製剤などモデル製剤を作製し、製剤の製造工程・保管・使用において、有効成分
及び製剤の有効性や安定性に寄与する添加剤の重要品質特性を評価し、必要に応じて新た
な分析手法を開発する。
• 遺伝子改変動物由来の臓器・組織
の品質・安全性が確保されるとともに
開発の円滑化に資する。
• 放射性医薬品特有の品質試験の考
え方の明示、研究開発から承認審
査までの考え方の提示により開発の
迅速化が見込まれる。また、革新的
な放射線治療機器の審査基準の策
定や国際標準評価法の開発を行い、
国内開発製品の海外への展開が促
される。
• ナノ粒子製剤を構成する高機能性
添加剤の品質評価技術の確立によ
り、当該領域の開発が迅速化する。
最先端技術を用いた革新的医薬品・医療機器・再生医療等製品等の実用化を促進
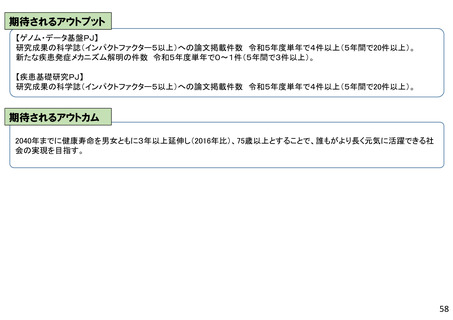
期待されるアウトプット、アウトカム
【アウトプット】
新モダリティ・先進手法に関する採択課題の割合を70%にすることで、革
新的な物も含めて医薬品等の品質・有効性・安全性に係る各種試験
系・評価系の薬事規制における活用や、各種評価に携わる人材の育成、
システム等の環境整備等に資するエビデンスを得る。
【アウトカム】
革新的な医薬品等の承認審査における留意点が明確化することによる開
発の効率化・予見性の向上並びに国際的な規制調和の推進によるわが
国発の医薬品等の国際展開への寄与が期待される。
11
課題・背景
• 「医療分野研究開発推進計画 (第2期) 」では、「医療現場のニーズに応える医薬品の実用化」のため、モダリ
ティの特徴や性質を考慮した研究開発を行うことが求められている。具体的には、各モダリティのデザイン、最適化、
活性評価、有効性・安全性評価手法、製造技術等の開発を行う、とされている。
• ガイドラインの国際協調を図ることは、グローバルな医薬品承認のタイムラグを最小化する上で極めて重要な要因
であり、日本が主導して評価法を開発し、国際動向をリードする必要がある。
• 高品質な医薬品等の安定供給のため、各種先進技術の医薬品等製造・管理技術の開発が期待されている。
令和5年度研究の概要
研究の成果・活用
新規公募課題を大きく3つのテーマにまとめる。公募研究の例を示す。
• 新規医薬品等の開発の環境整備に資する研究
遺伝子改変動物由来の臓器・組織を実用化するにあたって、品質・安全性を確保するための
技術的課題や評価要件、規制要件等を整理し、海外の規制の動向も踏まえ、遺伝子改変動
物由来の臓器・組織の品質・安全性に関するガイドライン案を作成する。
医薬品等に係る薬事規制の国際調和に資する研究
放射性医薬品の品質試験に求められる要件(試験精度、試験数、実施時期など)について、
最新の科学的知見や国際薬事規制を踏まえた見直し案を提案する。また、革新的放射線治
療機器の承認迅速化と早期普及を目指した次世代国際標準評価法の開発を行う。
• 医薬品等の品質、有効性、安全性等の評価、分析法等の開発に資する研究
ナノ粒子製剤に用いられる高機能性添加剤の開発状況や最新の分析技術を調査するとともに、
脂質ナノ粒子製剤などモデル製剤を作製し、製剤の製造工程・保管・使用において、有効成分
及び製剤の有効性や安定性に寄与する添加剤の重要品質特性を評価し、必要に応じて新た
な分析手法を開発する。
• 遺伝子改変動物由来の臓器・組織
の品質・安全性が確保されるとともに
開発の円滑化に資する。
• 放射性医薬品特有の品質試験の考
え方の明示、研究開発から承認審
査までの考え方の提示により開発の
迅速化が見込まれる。また、革新的
な放射線治療機器の審査基準の策
定や国際標準評価法の開発を行い、
国内開発製品の海外への展開が促
される。
• ナノ粒子製剤を構成する高機能性
添加剤の品質評価技術の確立によ
り、当該領域の開発が迅速化する。
最先端技術を用いた革新的医薬品・医療機器・再生医療等製品等の実用化を促進
期待されるアウトプット、アウトカム
【アウトプット】
新モダリティ・先進手法に関する採択課題の割合を70%にすることで、革
新的な物も含めて医薬品等の品質・有効性・安全性に係る各種試験
系・評価系の薬事規制における活用や、各種評価に携わる人材の育成、
システム等の環境整備等に資するエビデンスを得る。
【アウトカム】
革新的な医薬品等の承認審査における留意点が明確化することによる開
発の効率化・予見性の向上並びに国際的な規制調和の推進によるわが
国発の医薬品等の国際展開への寄与が期待される。
11