よむ、つかう、まなぶ。
医療法第25条第1項の規定に基づく立入検査要綱の一部改正について (57 ページ)
出典
| 公開元URL | |
| 出典情報 | 医療法第25条第1項の規定に基づく立入検査要綱の一部改正について(6/19付 通知)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
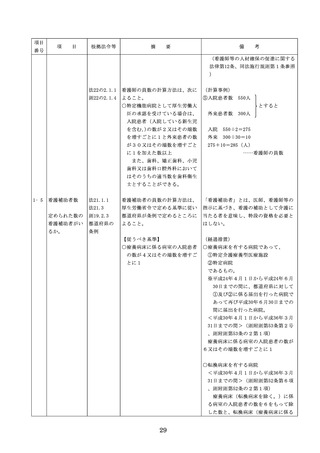
項目
項
番号
目
根拠法令等
摘
要
備
考
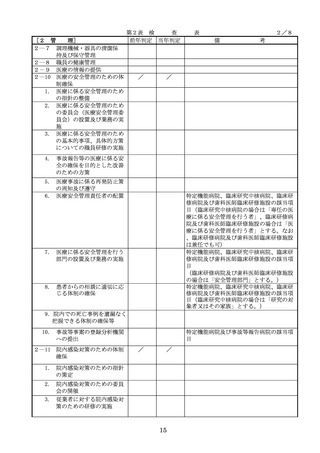
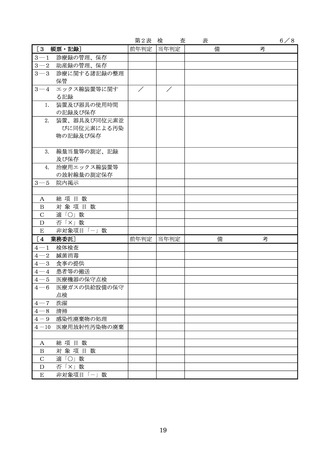
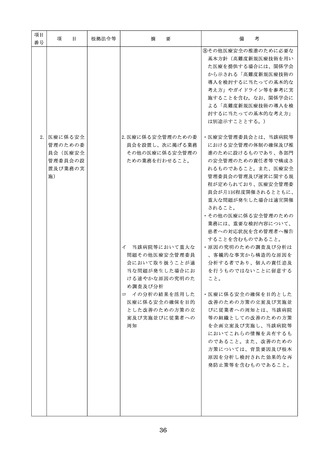
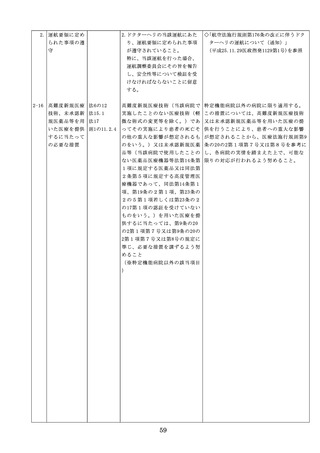
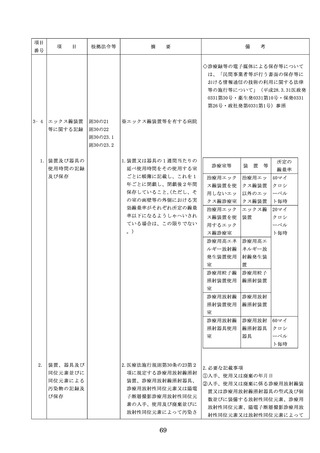
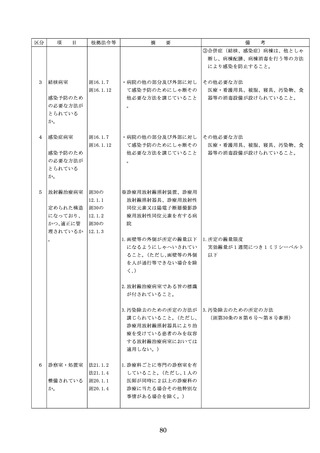
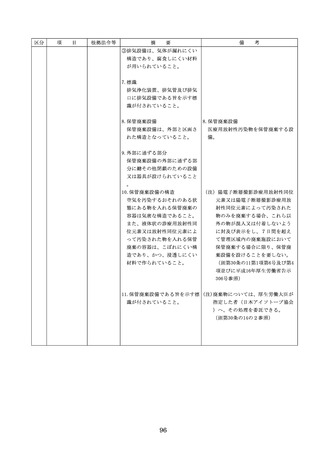
◇病院等における医薬品業務手順書の策
定については、「医薬品の安全使用のた
めの業務手順書作成マニュアルの改訂に
ついて」(平成30年12月28日付け厚生労
働省医政局総務課医療安全推進室・医薬
・生活衛生局総務課事務連絡)を参照
◇販売名の類似性に注意を要する医薬品の
安全な使用、及び特に安全管理が必要と
された医薬品(要注意薬)の適切な管理
などの医療事故防止対策については、「
医薬品の販売名の類似性等による医療事
故防止対策の強化・徹底について(注意
喚起)」(平成20.12.4医政発第1204001
号・薬食発第1204001号)を参照
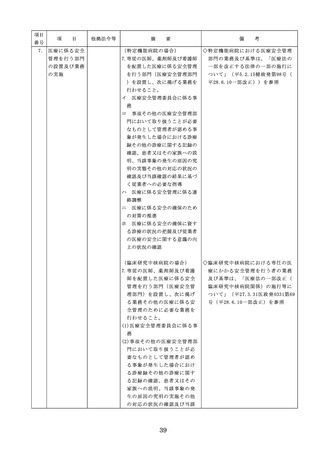
4. 医薬品安全管理
4.医薬品安全管理責任者により、
責任者による前
前記3.の業務の定期的な確認が
記3.の業務の定
実施されていること。
※総務省からの医療安全対策に関する勧告
事項(平成25年8月30日公表)
期的な確認の実
施
5
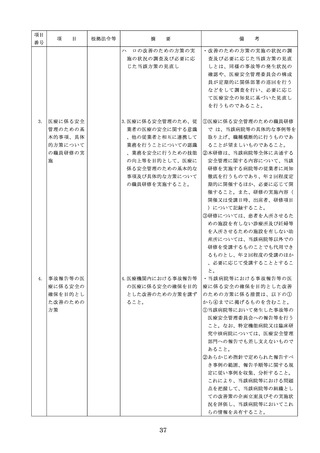
医薬品の安全使
5.医薬品の安全使用のために必要 ・医薬品安全管理責任者に対して、当該医
用のために必要
となる次に掲げる医薬品の使用
療機関における未承認等の医薬品の使用
となる未承認等
(以下、「未承認等の医薬品の
のための処方状況や採用されている医薬
の医薬品の使用
使用」という。)の情報その他
品全般の医薬品の添付文書の情報のほか
の情報その他の
の情報の収集その他の医薬品の
、医薬品製造販売業者、行政機関、学術
情報の収集その
安全使用を目的とした改善のた
誌等からの情報を広く収集し、管理させ
他の医薬品の安
めの方策の実施
るとともに、得られた情報のうち必要な
全使用を目的と
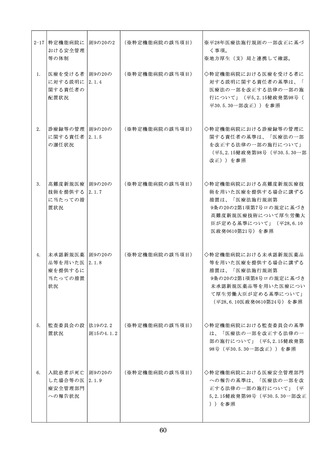
(1)医薬品医療機器等法第14条第1
ものは当該情報に係る医薬品を取り扱う
した改善のため
項に規定する医薬品であって、
従業者に迅速かつ確実に周知徹底を図ら
の方策
同項又は同法第19条の2第1項
せること。
の承認を受けていないものの使
用
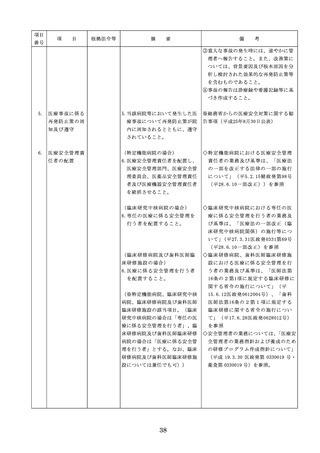
・情報の収集等に当たっては、医薬品医療
機器等法において、①製造販売業者等が
(2)医薬品医療機器等法第14条第1
行う医薬品の適正な使用のために必要な
項又は第19条の2第1項の承認
情報の収集に対して病院等が協力するよ
(同法第19条の2第5項におい
う努める必要があること等(医薬品医療
て準用する場合を含む。)を受
機器等法第68条の2第2項及び第3項)
けている医薬品の使用(当該承
、②病院若しくは診療所の開設者又は医
認に係る用法、用量、効能又は
師、歯科医師、薬剤師その他の医薬関係
効果(以下「用法等」という。
者は、医薬品について、当該品目の副作
)と異なる用法等で用いる場合
用等の発生を知った場合において、保健
に限り、(3)に該当する場合を除
衛生上の危害の発生又は拡大を防止する
く。)
ため必要があると認めるときは、厚生労
(3)禁忌に該当する医薬品の使用
働大臣に対して副作用等を報告すること
が義務付けられていること(医薬品医療機
器等法第68条の10第2項)に留意する必
要があること。
54
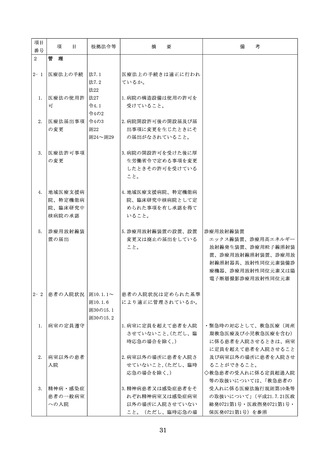
項
番号
目
根拠法令等
摘
要
備
考
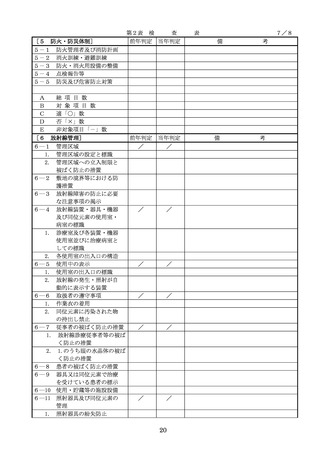
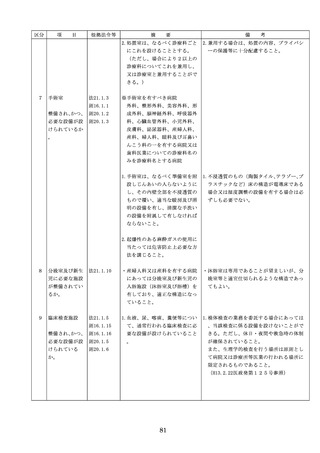
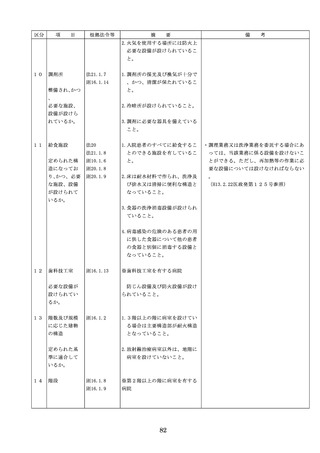
◇病院等における医薬品業務手順書の策
定については、「医薬品の安全使用のた
めの業務手順書作成マニュアルの改訂に
ついて」(平成30年12月28日付け厚生労
働省医政局総務課医療安全推進室・医薬
・生活衛生局総務課事務連絡)を参照
◇販売名の類似性に注意を要する医薬品の
安全な使用、及び特に安全管理が必要と
された医薬品(要注意薬)の適切な管理
などの医療事故防止対策については、「
医薬品の販売名の類似性等による医療事
故防止対策の強化・徹底について(注意
喚起)」(平成20.12.4医政発第1204001
号・薬食発第1204001号)を参照
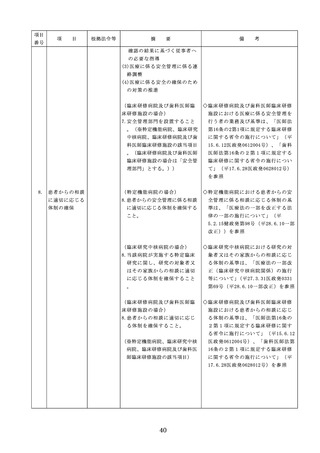
4. 医薬品安全管理
4.医薬品安全管理責任者により、
責任者による前
前記3.の業務の定期的な確認が
記3.の業務の定
実施されていること。
※総務省からの医療安全対策に関する勧告
事項(平成25年8月30日公表)
期的な確認の実
施
5
医薬品の安全使
5.医薬品の安全使用のために必要 ・医薬品安全管理責任者に対して、当該医
用のために必要
となる次に掲げる医薬品の使用
療機関における未承認等の医薬品の使用
となる未承認等
(以下、「未承認等の医薬品の
のための処方状況や採用されている医薬
の医薬品の使用
使用」という。)の情報その他
品全般の医薬品の添付文書の情報のほか
の情報その他の
の情報の収集その他の医薬品の
、医薬品製造販売業者、行政機関、学術
情報の収集その
安全使用を目的とした改善のた
誌等からの情報を広く収集し、管理させ
他の医薬品の安
めの方策の実施
るとともに、得られた情報のうち必要な
全使用を目的と
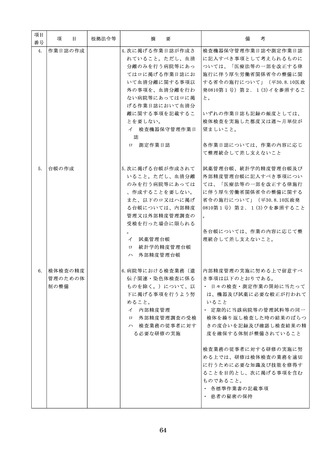
(1)医薬品医療機器等法第14条第1
ものは当該情報に係る医薬品を取り扱う
した改善のため
項に規定する医薬品であって、
従業者に迅速かつ確実に周知徹底を図ら
の方策
同項又は同法第19条の2第1項
せること。
の承認を受けていないものの使
用
・情報の収集等に当たっては、医薬品医療
機器等法において、①製造販売業者等が
(2)医薬品医療機器等法第14条第1
行う医薬品の適正な使用のために必要な
項又は第19条の2第1項の承認
情報の収集に対して病院等が協力するよ
(同法第19条の2第5項におい
う努める必要があること等(医薬品医療
て準用する場合を含む。)を受
機器等法第68条の2第2項及び第3項)
けている医薬品の使用(当該承
、②病院若しくは診療所の開設者又は医
認に係る用法、用量、効能又は
師、歯科医師、薬剤師その他の医薬関係
効果(以下「用法等」という。
者は、医薬品について、当該品目の副作
)と異なる用法等で用いる場合
用等の発生を知った場合において、保健
に限り、(3)に該当する場合を除
衛生上の危害の発生又は拡大を防止する
く。)
ため必要があると認めるときは、厚生労
(3)禁忌に該当する医薬品の使用
働大臣に対して副作用等を報告すること
が義務付けられていること(医薬品医療機
器等法第68条の10第2項)に留意する必
要があること。
54