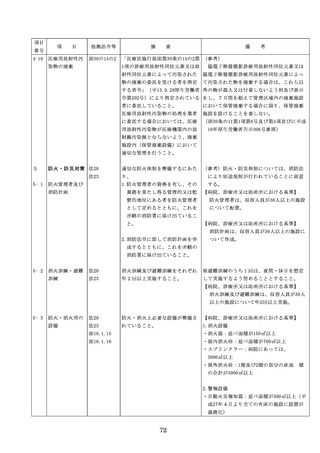
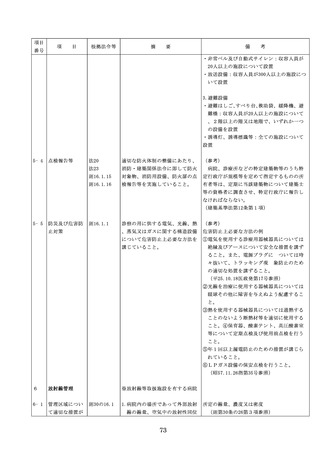
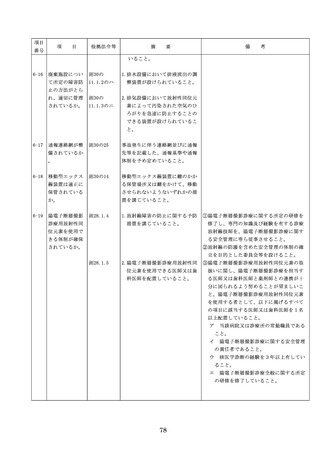
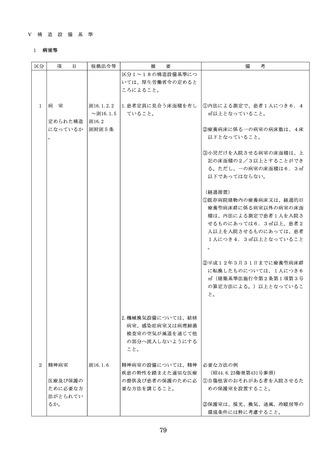
よむ、つかう、まなぶ。
医療法第25条第1項の規定に基づく立入検査要綱の一部改正について (60 ページ)
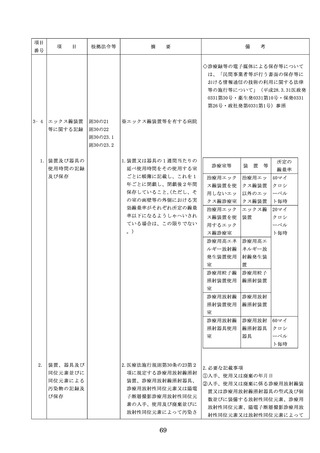
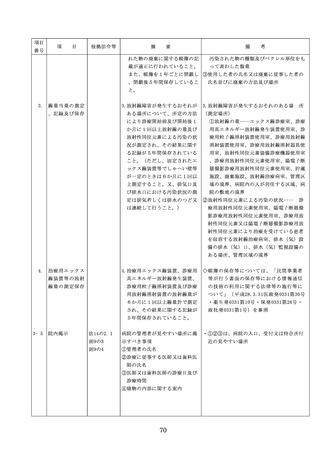
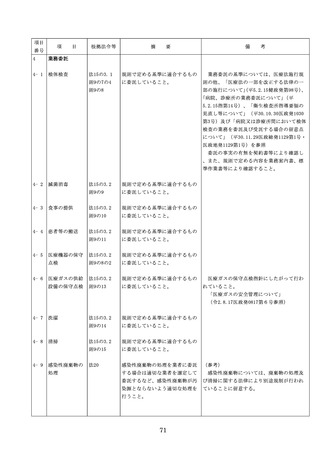
出典
| 公開元URL | |
| 出典情報 | 医療法第25条第1項の規定に基づく立入検査要綱の一部改正について(6/19付 通知)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
4
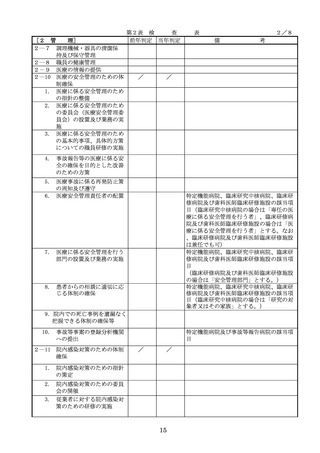
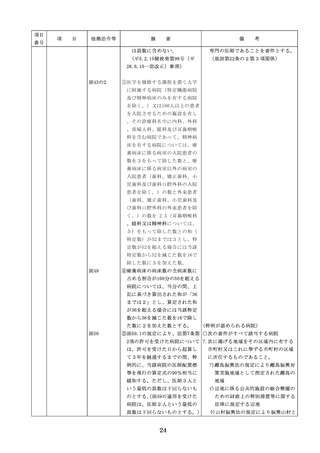
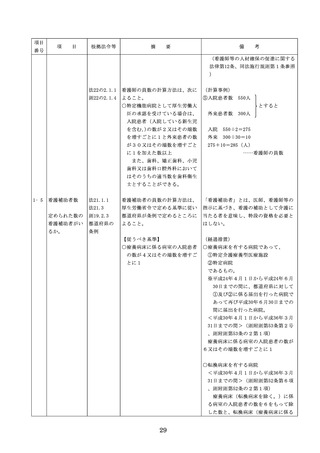
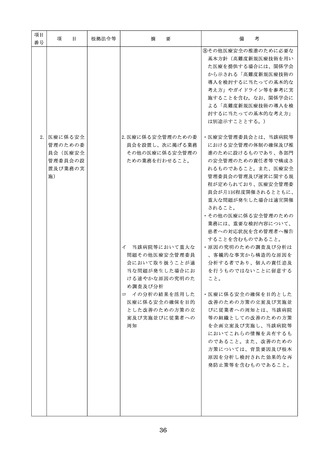
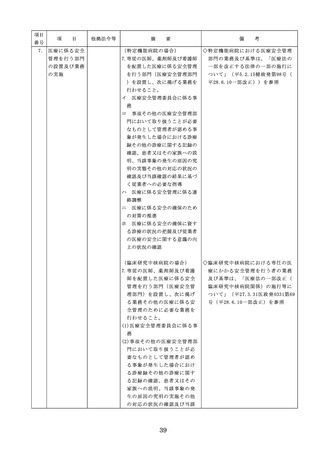
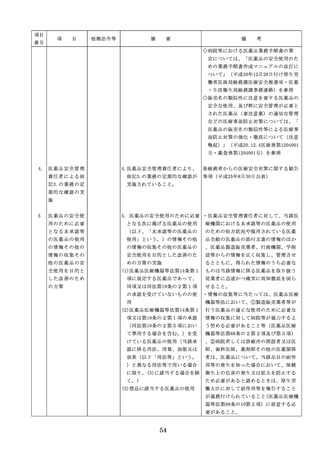
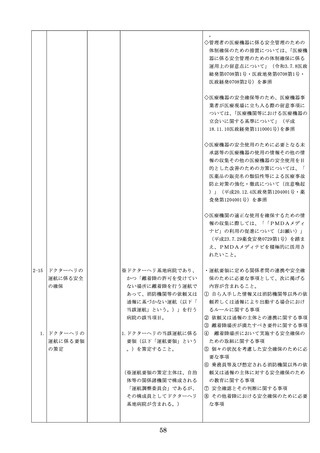
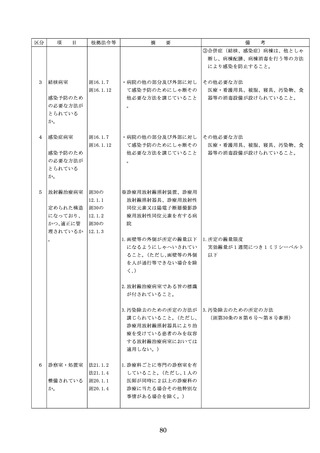
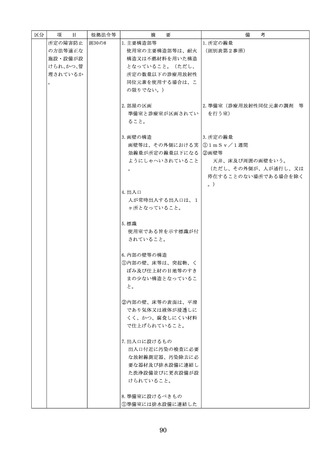
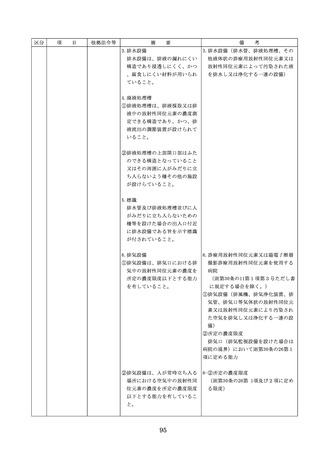
医療機器の安全
4.医療機器の安全使用のために必
・未承認等の医療機器の使用(未承認・未認
使用のために必
要となる次に掲げる使用の情報
証・未届の医療機器の使用、適用外使用、
要となる未承認
その他の情報の収集その他の医
禁忌・禁止での使用)の情報その他の情報
等の医療機器の
療機器の安全使用を目的とした
の収集その他の医療機器の安全使用を目的
使用の情報その
改善のための方策の実施
とした改善のための方策の実施については
他の情報の収集
(1)医薬品医療機器等法第2条第
、次の要件を満たすものとすること。
その他の医療機
4項に規定する医療機器であっ
①添付文書等の管理
器の安全使用を
て、同法第23条の2の5第1項
医療機器安全管理責任者は、医療機器の
目的とした改善
若しくは第23条の2の17第1項
添付文書、取扱説明書等の医療機器の安
のための方策
の承認若しくは同法第23条の2
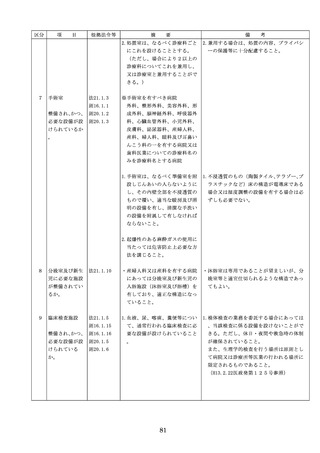
全使用・保守点検等に関する情報を整理
の23第1項の認証を受けていな
し、その管理を行うこと。
いもの又は同法第23条の2の12
②医療機器に係る安全情報等の収集医療機
第1項の規定による届出が行わ
器安全管理責任者は、医療機器の不具合
れていないものの使用
情報や安全性情報等の安全使用のために
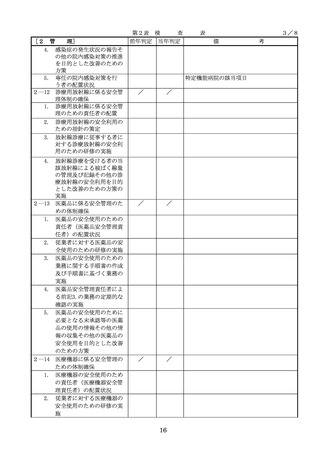
(2)医薬品医療機器等法第23条の
必要な情報を製造販売業者等から一元的
2の5第1項若しくは第23条の
に収集するとともに、得られた情報を当
2の17第1項の承認(同法第23
該医療機器に携わる者に対して適切に提
条の2の5第11項(同法第23条
供すること。
の2の17第5項において準用す
③病院等の管理者への報告
る場合を含む。)の変更の承認
医療機器安全管理責任者は、管理してい
を含む。)若しくは同法第23条
る医療機器の不具合や健康被害等に関す
の2の23第1項の認証(同条第
る内外の情報収集に努めるとともに、当
6項の変更の認証を含む。)を
該病院等の管理者への報告等を行うこと
受けている医療機器又は同法第
。
23条の2の12第1項の規定によ
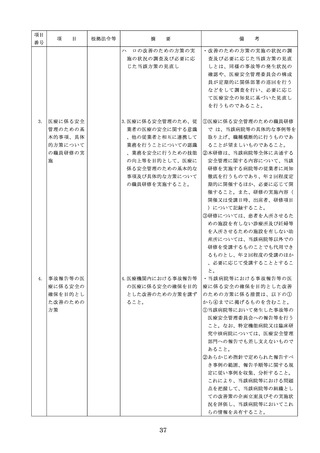
る届出(同条第2項の規定によ
・情報の収集等に当たっては、医薬品医療機
る変更の届出を含む。)が行わ
器等法において、① 製造販売業者等が行う
れている医療機器の使用(当該
医療機器の適正な使用のために必要な情報
承認、認証又は届出に係る使用
の収集に対して病院等が協力するよう努め
方法、効果又は効能(以下「使
る必要があること等(医薬品医療機器等法
用方法等」という。)と異なる
第68条の2第2項及び第3項)、② 病院若
使用方法等で用いる場合に限り
しくは診療所の開設者又は医師、歯科医師
、(3)に該当する場合を除く。
、薬剤師その他の医薬関係者は、医療機器
)
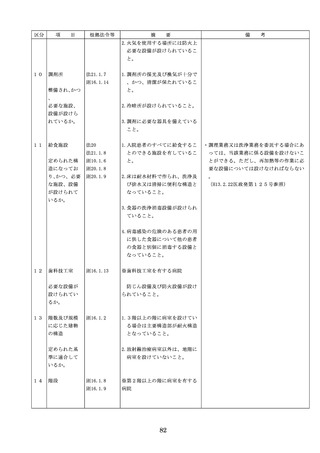
について、当該品目の副作用等の発生を知
(3)禁忌又は禁止に該当する医療
機器の使用
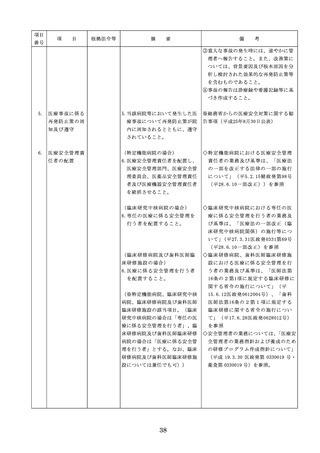
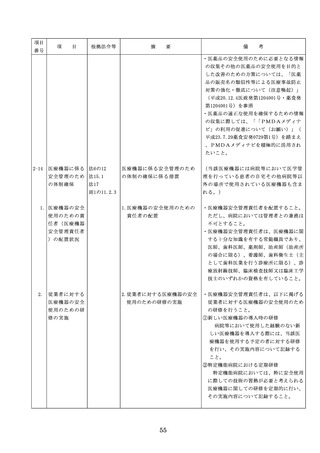
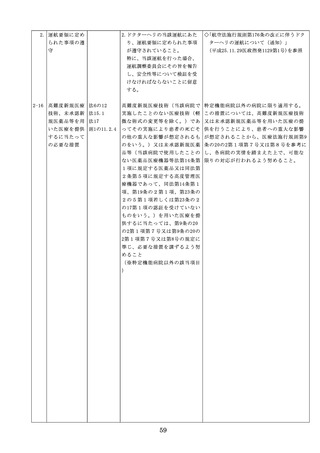
った場合において、保健衛生上の危害の発
生又は拡大を防止するため必要があると認
めるときは、厚生労働大臣に対して副作用
等を報告することが義務付けられているこ
と(医薬品医療機器等法第68条の10第2項)
に留意する必要があることに加え、当該医
療機関で事前に使用したことのない未承認
・未認証の高度管理医療機器を採用・購入
するに当たっては、当該医療機器の使用の
妥当性について、関係学会のガイドライン
等の科学的知見を確認するとともに、関係
学会のガイドライン等に記載がなく、科学
的根拠が確立していない未承認・未認証の
高度管理医療機器の使用に当たっては、そ
の有効性・安全性の検証を十分に行うこと
57
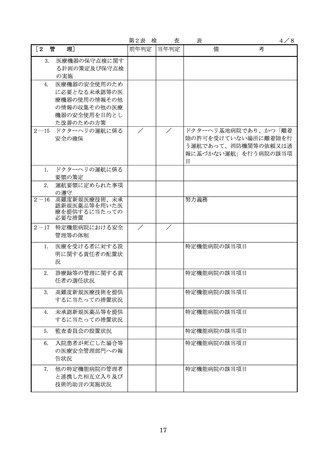
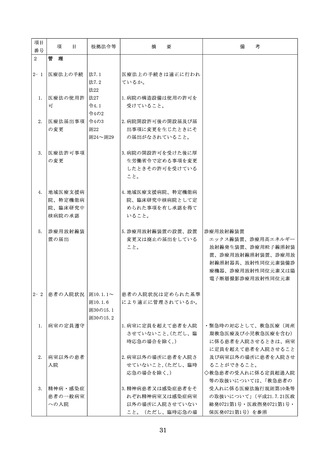
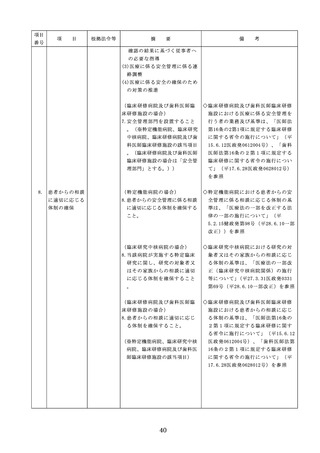
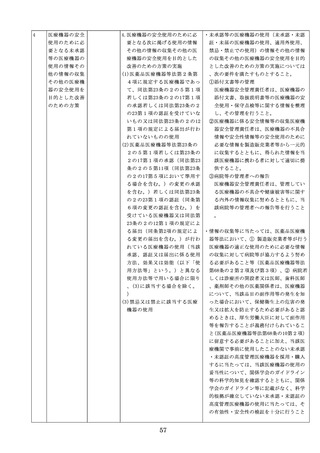
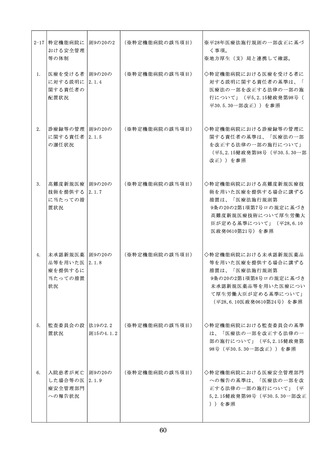
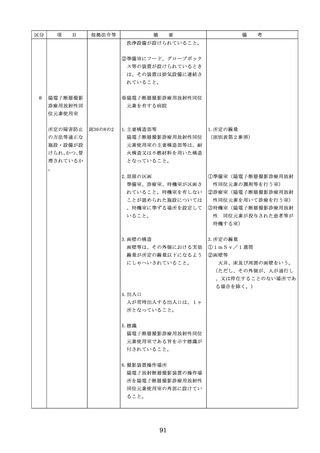
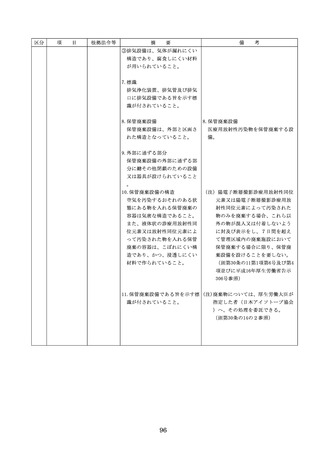
医療機器の安全
4.医療機器の安全使用のために必
・未承認等の医療機器の使用(未承認・未認
使用のために必
要となる次に掲げる使用の情報
証・未届の医療機器の使用、適用外使用、
要となる未承認
その他の情報の収集その他の医
禁忌・禁止での使用)の情報その他の情報
等の医療機器の
療機器の安全使用を目的とした
の収集その他の医療機器の安全使用を目的
使用の情報その
改善のための方策の実施
とした改善のための方策の実施については
他の情報の収集
(1)医薬品医療機器等法第2条第
、次の要件を満たすものとすること。
その他の医療機
4項に規定する医療機器であっ
①添付文書等の管理
器の安全使用を
て、同法第23条の2の5第1項
医療機器安全管理責任者は、医療機器の
目的とした改善
若しくは第23条の2の17第1項
添付文書、取扱説明書等の医療機器の安
のための方策
の承認若しくは同法第23条の2
全使用・保守点検等に関する情報を整理
の23第1項の認証を受けていな
し、その管理を行うこと。
いもの又は同法第23条の2の12
②医療機器に係る安全情報等の収集医療機
第1項の規定による届出が行わ
器安全管理責任者は、医療機器の不具合
れていないものの使用
情報や安全性情報等の安全使用のために
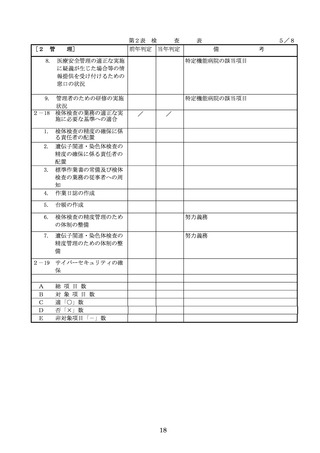
(2)医薬品医療機器等法第23条の
必要な情報を製造販売業者等から一元的
2の5第1項若しくは第23条の
に収集するとともに、得られた情報を当
2の17第1項の承認(同法第23
該医療機器に携わる者に対して適切に提
条の2の5第11項(同法第23条
供すること。
の2の17第5項において準用す
③病院等の管理者への報告
る場合を含む。)の変更の承認
医療機器安全管理責任者は、管理してい
を含む。)若しくは同法第23条
る医療機器の不具合や健康被害等に関す
の2の23第1項の認証(同条第
る内外の情報収集に努めるとともに、当
6項の変更の認証を含む。)を
該病院等の管理者への報告等を行うこと
受けている医療機器又は同法第
。
23条の2の12第1項の規定によ
る届出(同条第2項の規定によ
・情報の収集等に当たっては、医薬品医療機
る変更の届出を含む。)が行わ
器等法において、① 製造販売業者等が行う
れている医療機器の使用(当該
医療機器の適正な使用のために必要な情報
承認、認証又は届出に係る使用
の収集に対して病院等が協力するよう努め
方法、効果又は効能(以下「使
る必要があること等(医薬品医療機器等法
用方法等」という。)と異なる
第68条の2第2項及び第3項)、② 病院若
使用方法等で用いる場合に限り
しくは診療所の開設者又は医師、歯科医師
、(3)に該当する場合を除く。
、薬剤師その他の医薬関係者は、医療機器
)
について、当該品目の副作用等の発生を知
(3)禁忌又は禁止に該当する医療
機器の使用
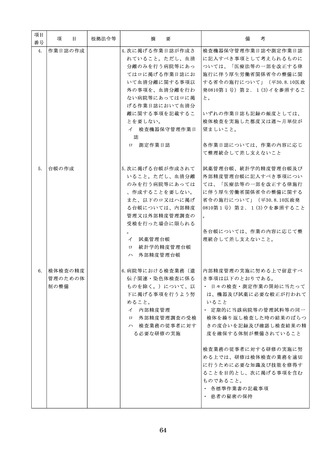
った場合において、保健衛生上の危害の発
生又は拡大を防止するため必要があると認
めるときは、厚生労働大臣に対して副作用
等を報告することが義務付けられているこ
と(医薬品医療機器等法第68条の10第2項)
に留意する必要があることに加え、当該医
療機関で事前に使用したことのない未承認
・未認証の高度管理医療機器を採用・購入
するに当たっては、当該医療機器の使用の
妥当性について、関係学会のガイドライン
等の科学的知見を確認するとともに、関係
学会のガイドライン等に記載がなく、科学
的根拠が確立していない未承認・未認証の
高度管理医療機器の使用に当たっては、そ
の有効性・安全性の検証を十分に行うこと
57