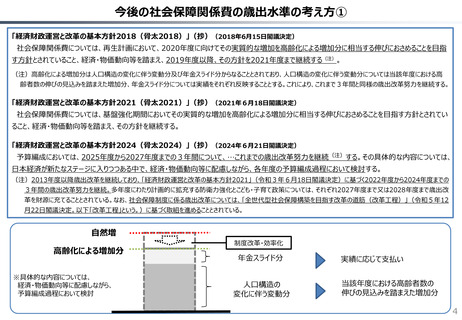
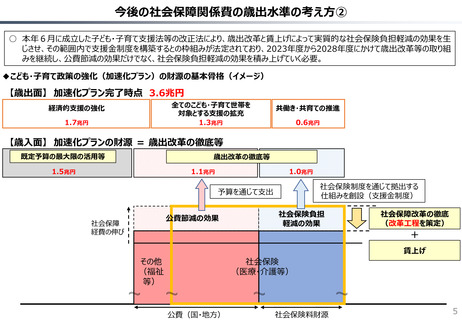
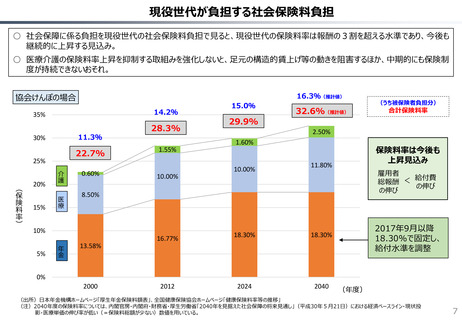
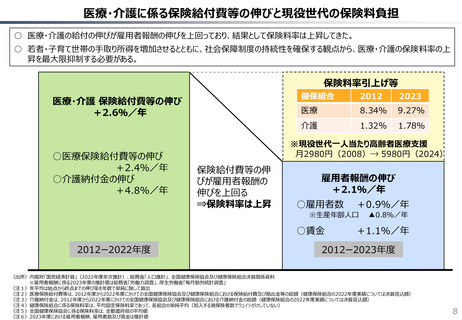
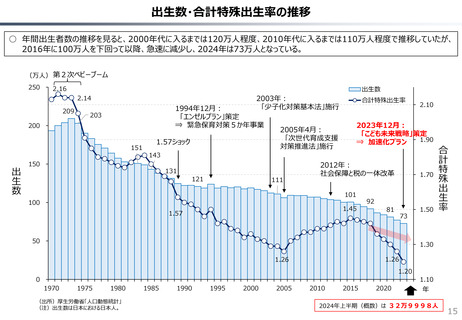
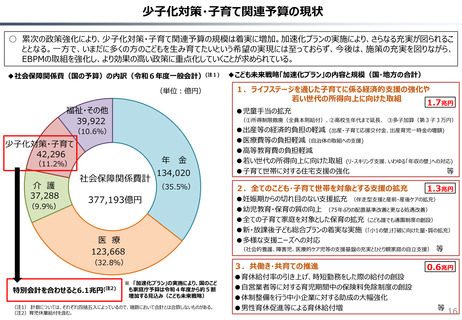
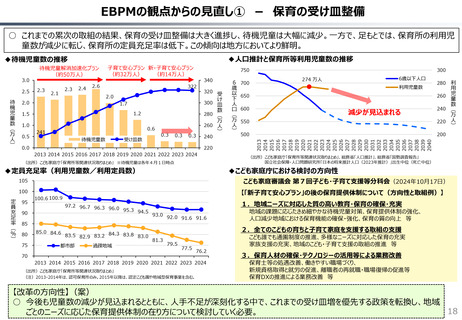
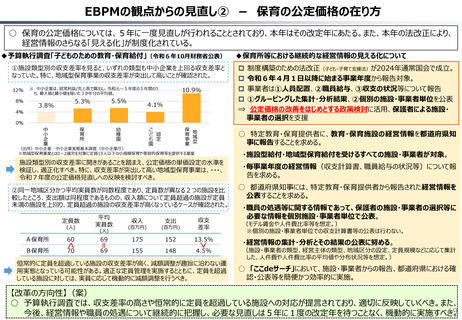
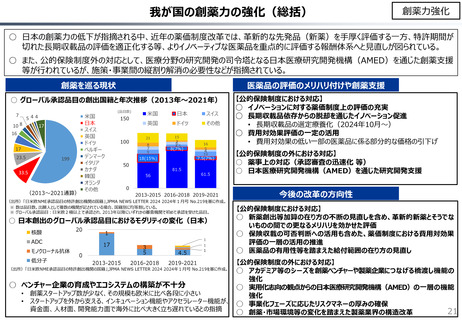
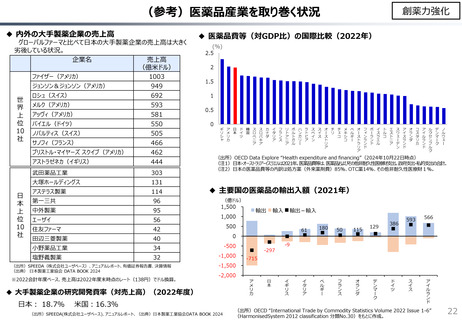
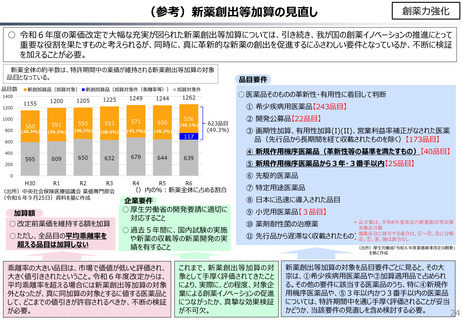
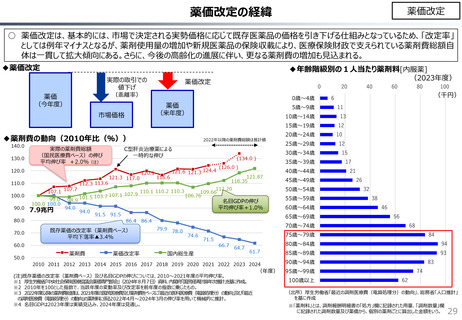
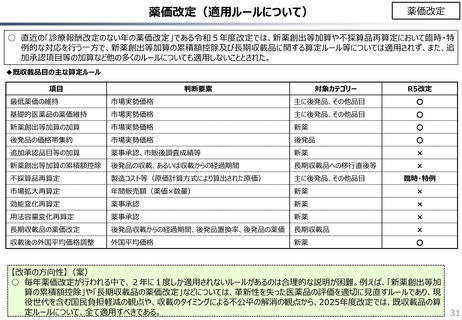
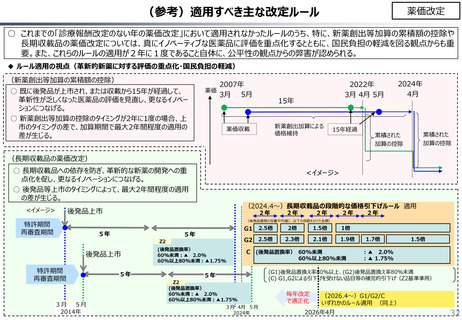
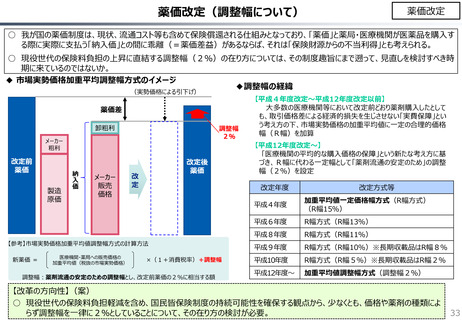
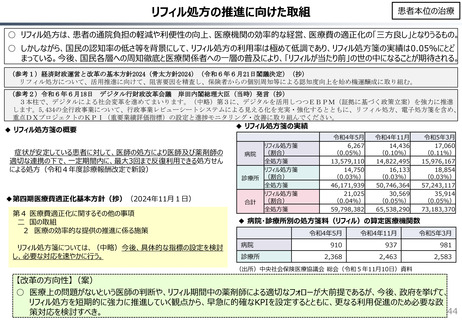
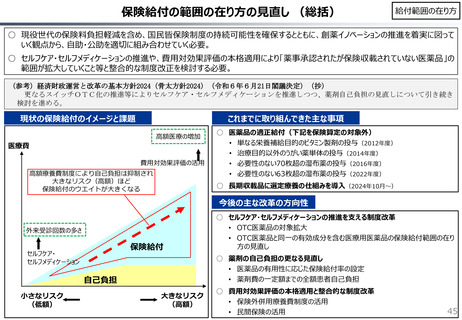
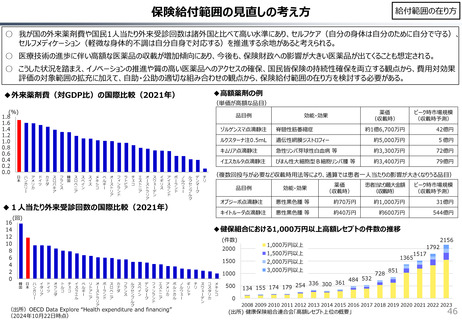
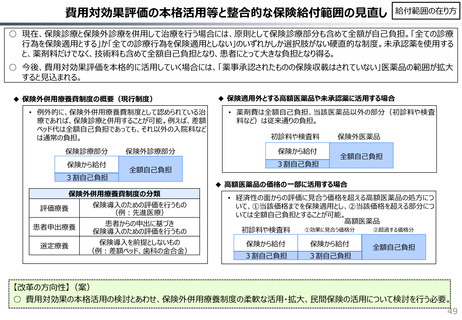
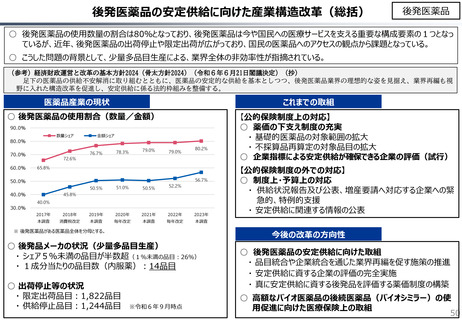
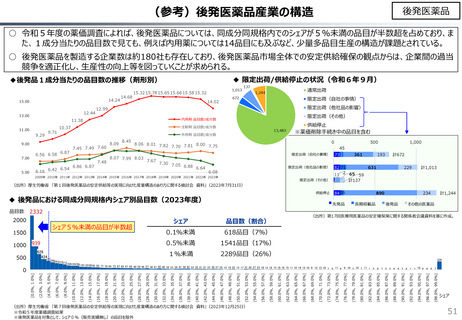
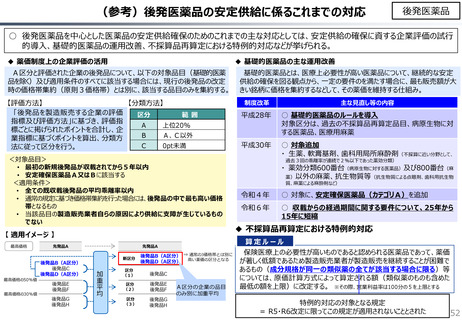
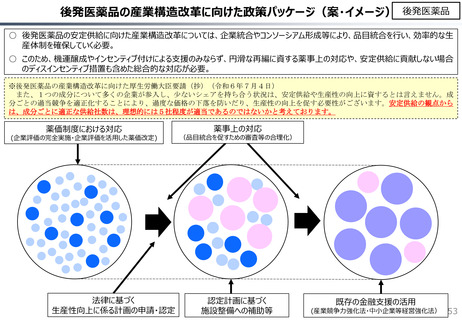
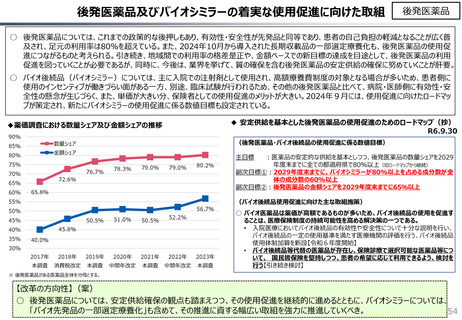
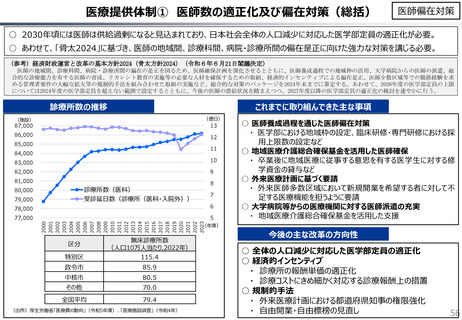
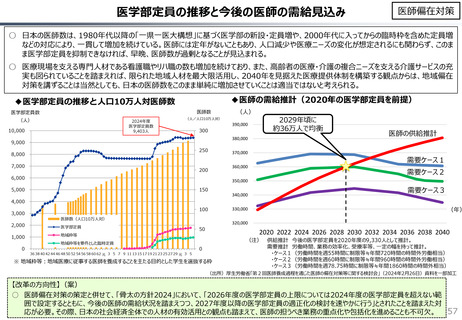
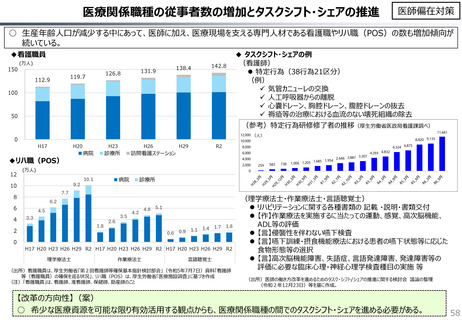
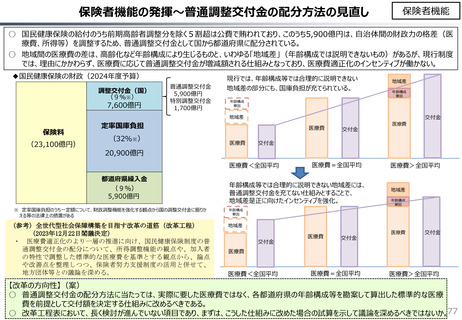
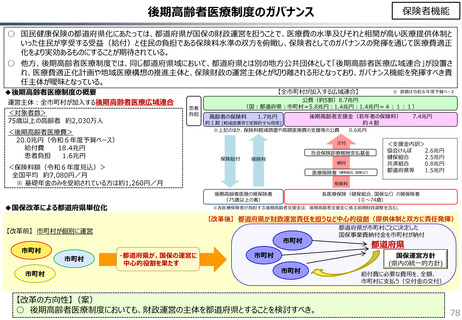
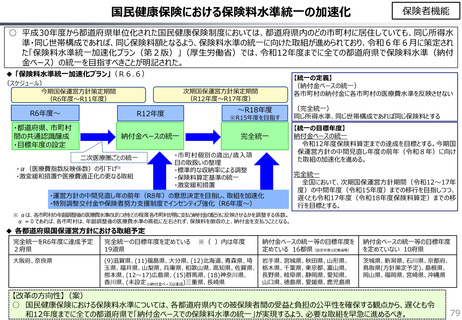
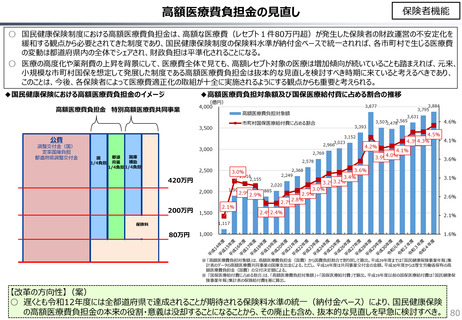
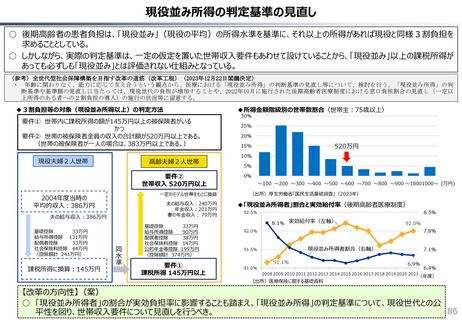
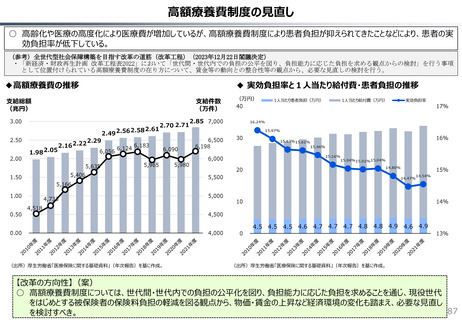
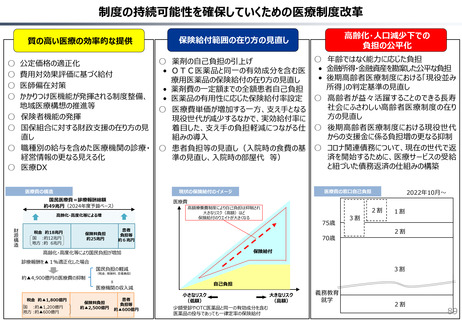
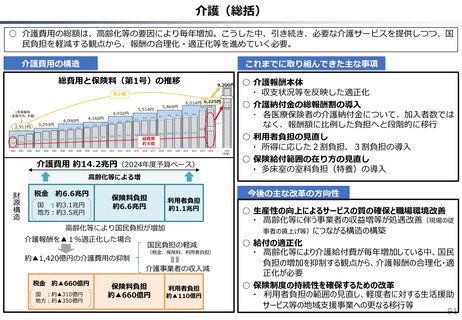
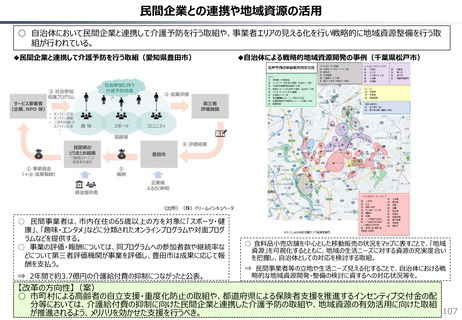
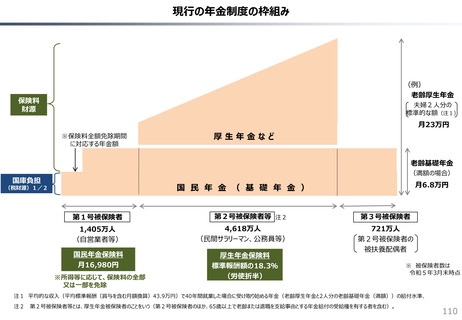
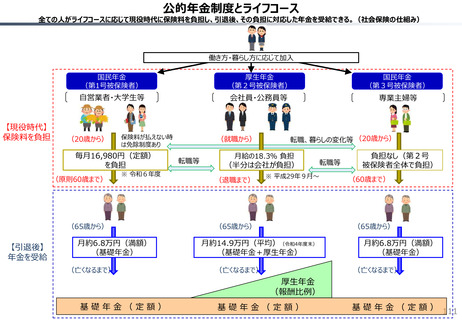
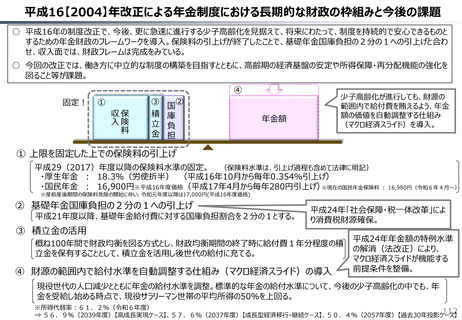
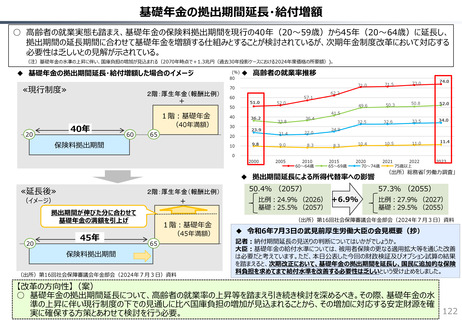
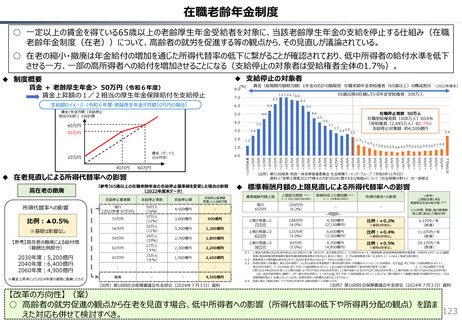
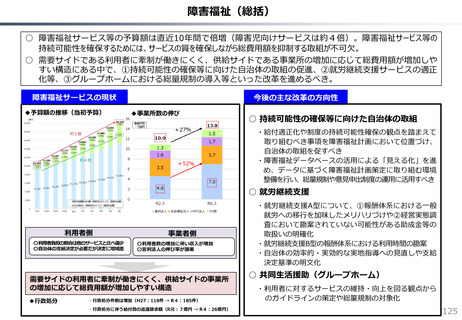
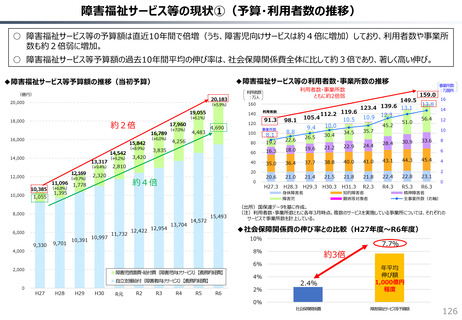
社会保障 (41 ページ)
出典
| 公開元URL | https://www.mof.go.jp/about_mof/councils/fiscal_system_council/sub-of_fiscal_system/proceedings/material/20241113zaiseia.html |
| 出典情報 | 財政制度等審議会 財政制度分科会(11/13)《財務省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
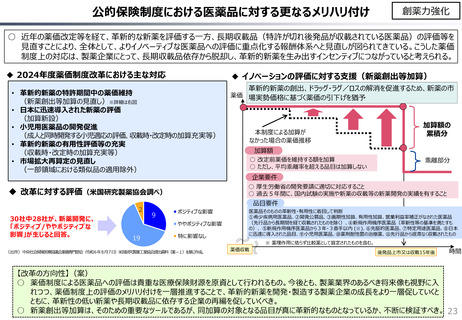
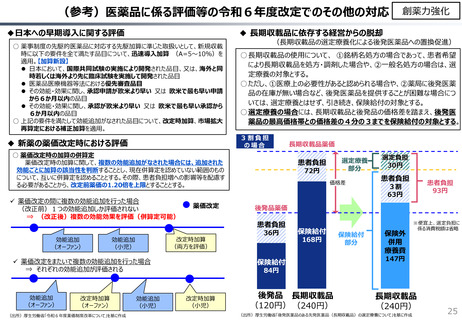
費用対効果等
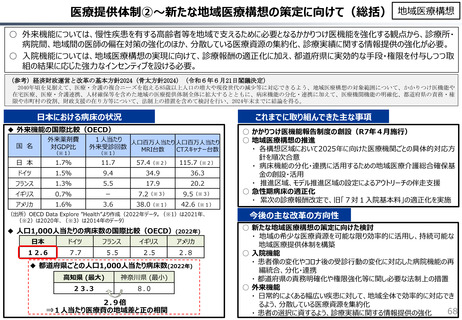
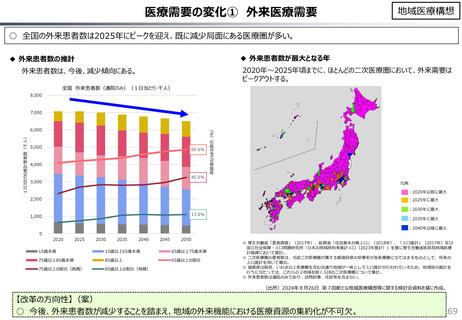
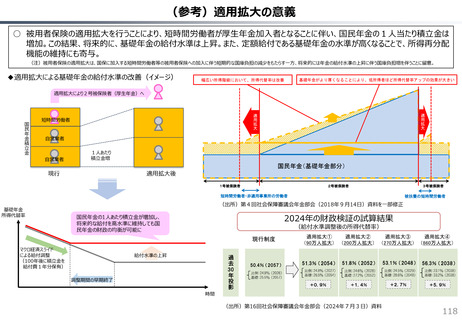
○ 日本で承認された新薬の製品数は米国と遜色なく、むしろカントリードラッグ(日本でしか流通していない新薬)が多いとの指摘があるが、
その背景には、費用対効果が顧みられることなく、原則、薬事承認された医薬品がすぐさま保険収載されるという日本の薬価制度の特
徴があると考えられる。
○ 諸外国では、費用対効果評価や追加的有用性評価を本格適用して保険収載・薬価設定に活用していることも踏まえれば、今後、日
本でも、真に革新的な新薬とそうでないものを区分し差別化した価格設定を行うことは、我が国の医薬品市場の魅力を高め、製薬企
業の国際競争力の強化にもつながるとともに、ひいては国民の革新的な医薬品へのアクセス改善につながると考えられる。
◆カントリードラッグの状況
◆新薬の上市状況に関する国際比較
『薬剤給付制度の薬価偏重からの脱却を-給付対象の限定と医師の処
方行動への働きかけを-』(日本総研調査部主任研究員 成瀬道紀
氏)(抜粋)
米国と他の高所得国(26か国)の新薬の上市状況(2018年~2022年)
を調査した米国調査機関のレポートでは、以下の指摘がなされている。
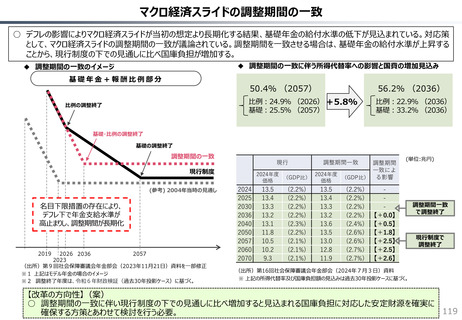
承認された新薬が原則すべて保険収載されることにより以下のよう
な影響が生じている。澁口[2021]によれば、2010 ~ 2019年
に承認されたNME(新有効成分含有医薬品)の数は、わが国は
398品目と世界最大の医薬品市場を誇るアメリカ(378品目)を
も上回る(注23)。世界でよく売れている新薬でドラッグ・ラグ、ドラッ
グ・ロスが生じている現象と一見矛盾するようであるが、要は海外では
通用しない新薬がわが国で多数承認されているのである。既存薬とさ
ほど効果が変わらないような費用対効果が悪い新薬は、海外では給
付対象とならない可能性が高い。こうした新薬でも承認されれば自動
的に保険収載されるわが国の市場は、費用対効果に劣る新薬にとっ
ては魅力的であり、わが国だけで開発・申請されている新薬も少なく
ないとみられる。
(注23)集計期間が2013 ~ 2019年と日米と異なるが、EUの医薬品承認
審査機関である欧州医薬品庁(EMA)が承認したNMEの品目数は275品目
である。
参考文献:澁口朋之[2021].「日米欧NME承認品目の創出企業の国
籍―2010 ~ 2019年の承認品目を中心に―」政策研ニュース No.62
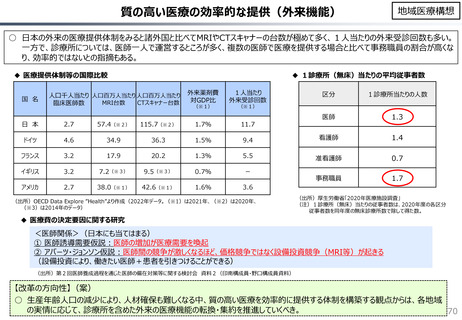
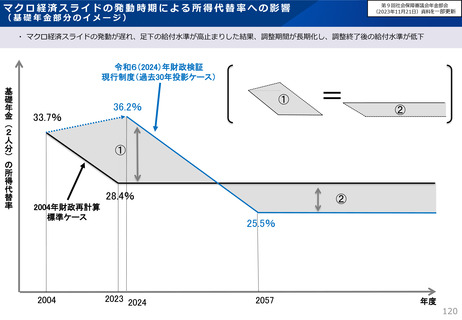
• 半数以上の新薬はまず米国で販売される
• 米国で販売された新薬は約1年後に他の主要国(*)で販売さ
れるのが典型的である。*豪、加、仏、独、日、英
• ほとんどの国において、新薬のうち米国で販売されていないものが
占める割合は小さい。日本はこの割合が39%(122新薬のう
ち47新薬)と顕著な例外である
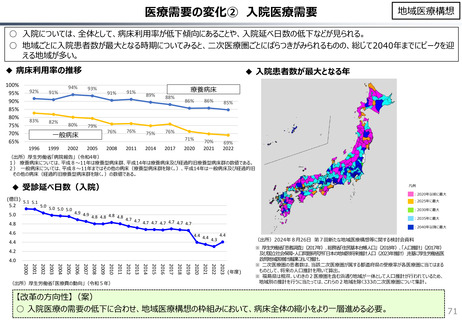
【米国で販売されてない新薬の新薬総数に占める割合(注)】
(注)独、仏、英についてはレポート記載のデータから財務省で計算
•
•
•
•
•
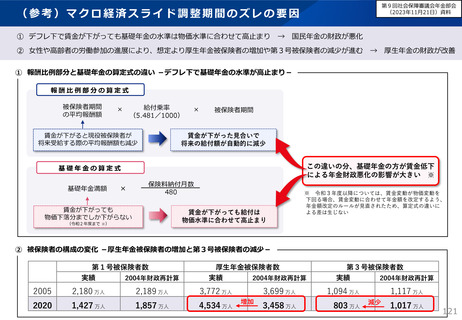
日本 :39%(122新薬のうち47新薬)
独
:13%(149新薬のうち20新薬)
仏
:12%(98新薬のうち12新薬)
英
:11%(122新薬のうち14新薬)
カナダ :5%(80新薬のうち4新薬)
(出所)Mulcahy, Andrew W., Comparing New Prescription Drug Availability and
Launch Timing in the United States and Other OECD Countries, RAND Corporation,
RR-A788-4, 2024. As of April 3, 2024:
https://www.rand.org/pubs/research_reports/RRA788-4.html
40