令和7年度厚生労働省予算案の主要事項 (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/wp/yosan/yosan/25syokanyosan/index.html |
| 出典情報 | 令和7年度厚生労働省所管予算案関係(12/27)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
医政局研究開発政策課(内線2542)
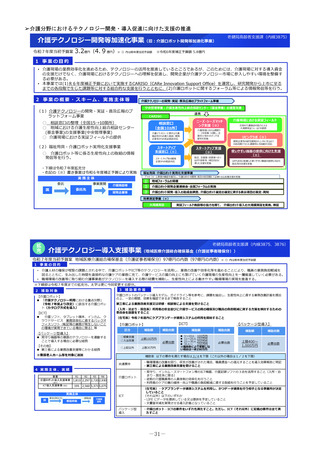
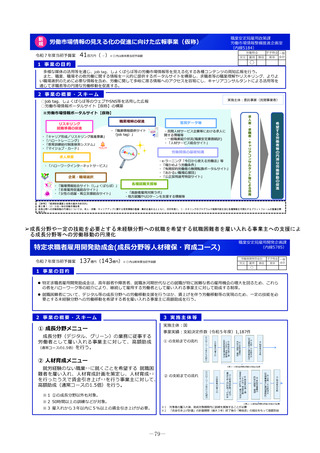
小児医薬品開発支援体制強化事業
令和7年度当初予算案
30百万円(-)※()内は前年度当初予算額
1 事業の目的
日本において、小児や希少疾病等の医薬品を中心として、ドラッグ・ラグ/ドラッグ・ロスの懸念が生じており、必要な医薬品が迅速に利用できない患者が存在して
いる状況にあると言われている(※)。
小児領域の医薬品開発を促進するため、国立成育医療研究センターにおける小児医薬品開発支援の体制を強化し、小児用医薬品開発のサポート(製薬企
業、アカデミア等への開発サポート等)を強化する。
※医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会 報告書(令和5年6月9日)
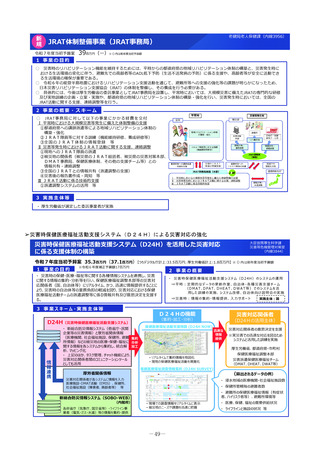
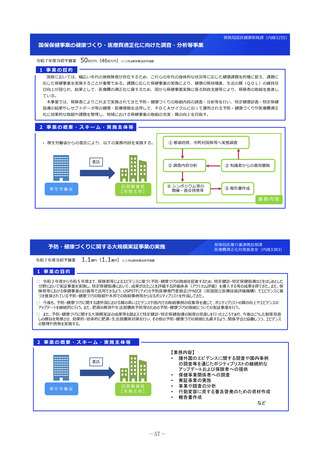
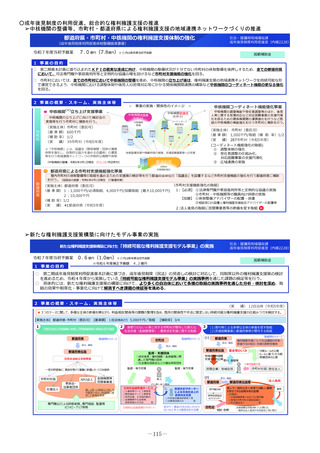
2 事業の概要・スキーム
厚生労働省
国立研究開発法人 国立成育医療研究センター
(i)小児医薬品開発支援の体制強化
・アカデミア等からの出向者の受け入れ、SMO/CROへの業務委託
(ii)小児医薬品開発支援内容の充実
・新たにアカデミア主導での小児医薬品開発を支援
・開発のサポート(実施の可能性・コンセプト・計画等への助言、関連学会との連携の支援、規制当局対応に関する相談等)
・国内における使用実態等公知申請に必要となる情報収集の支援(小児医療情報収集システム(DB)活用による情報収集を含む)
・開発企業がいない小児用医薬品の開発に関して、必要に応じて治験を支援(※)し、企業導出を支援(プロトコル作成助言等)
※国立研開発法人 日本医療研究開発機構(AMED)臨床研究・治験推進研究事業
(iii)小児治験ネットワークとの連携・体制強化
・小児治験ネットワーク体制の強化、産学官患からなる小児医薬品開発推進のコンソーシアムの立ち上げ事務局機能を担当
・国内小児治験について、小児治験ネットワーク等につなぎ、被験者の組入れを加速化
(iv)小児治験に関する普及啓発・研修の実施
・保護者、患者会:DCTを含む小児治験の普及啓発による患者参画の推進(関係学会と連携)
・医療従事者:小児用医薬品治験に関する理解、DCT治験に関する知識を広めるための講習会を開催
・製薬企業:小児治験ネットワーク及び本支援スキームの普及啓発の強化
・関係学会:治験登録促進の呼びかけ、DCTの理解・普及啓発
等
3 実施主体等
◆ 実施主体:国立研究開発法人 国立成育医療研究センター◆ 補助率:10/10 ◆対象経費:補助金(人件費等)
医政局研究開発政策課(内線2542)
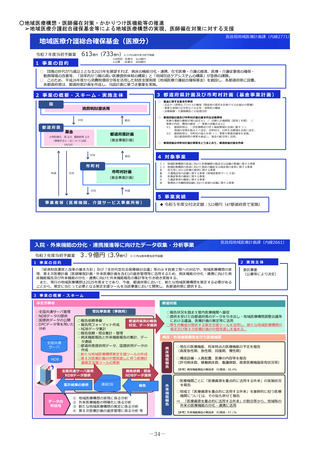
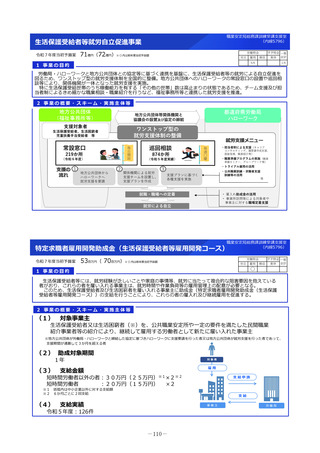
臨床研究・治験推進研究事業
令和7年度当初予算案
32億円(32億円)※()内は前年度当初予算額
1 事業の目的
有望な医薬品シーズがアカデミアや企業で見いだされても、その後の臨床研究や治験を効率的に実施しなければ、早期の薬事承認に繋がらない。
日本で生み出された基礎研究の成果を薬事承認につなげ、革新的な医薬品を創出するため、科学性及び倫理性が十分に担保され得る質の高い臨床研
究・治験を推進する。
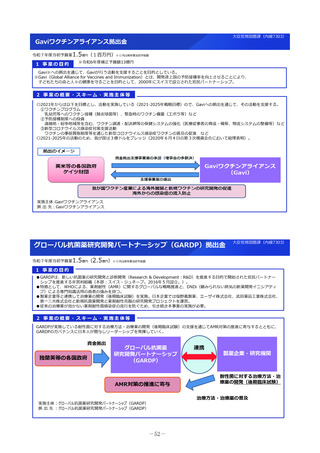
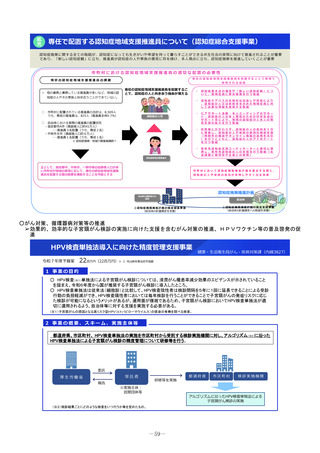
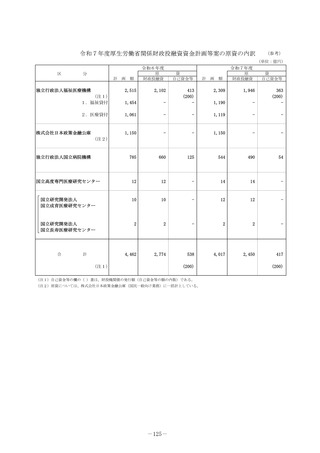
2 事業の概要・スキーム
• 企業による開発が進まない医薬品についてはアカデミア主導での開発を進める必要があり、関係学会の協力の下で実施される医師主導治験の実施
を支援する。
• 医薬品の小児適応に係る研究開発は、ニーズは高いが採算性が低く、企業による開発が進みにくい。医療安全の観点からも、小児での有効性・安
全性が確立していない医薬品についてエビデンス構築が求められていることから、小児を対象とした臨床研究・医師主導治験等を促進する。
<支援に係る主なコンセプト>
臨床研究・治験の推進
疾患の希少性、不採算性等を総合的に考慮し、公益性の高い
特定臨床研究・医師主導治験を支援
臨床研究・医師主導治験のプロトコール作成
特定臨床研究の実施
医師主導治験(新有効成分、新効能、新用量医薬品)の実施
小児を対象とした特定臨床研究・医師主導治験等の実施
認知症を対象とした特定臨床研究・医師主導治験・企業
治験等の実施
①患者ニーズの高いもの
②疾患登録システム(患者レジス
トリ)等の活用
疾患登録システムを、薬事承認申請に利用可能な比較対照群等
に利活用する、特定臨床研究・医師主導治験の実施を支援
③ Decentralized Clinical Trial
(DCT)等の新しい手法の活用
デジタルデバイス、オンライン診療等の新しい技術や訪問診療
等を活用し、被験者の安全性やデータの信頼性を担保しつつ、
被験者や関係者の負担を軽減し得る臨床試験(Decentralized
Clinical Trial;分散型臨床試験)等の新しい手法を活用した特
定臨床研究・医師主導治験のプロトコール作成、実施を支援
3 実施主体等
◆ 補助先:国立研究開発法人日本医療研究開発機構(AMED) ◆補助率:定額 ※AMEDにおいて公募により研究者・民間事業者等を選定
-20-