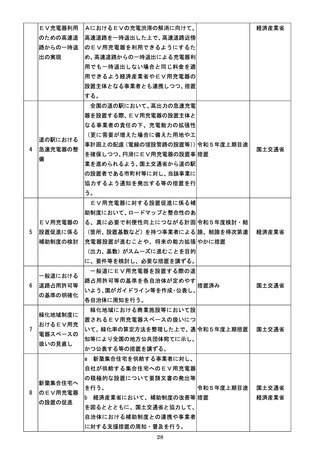
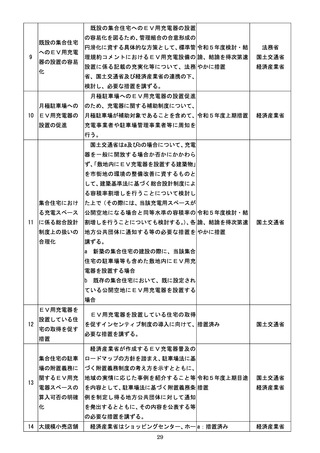
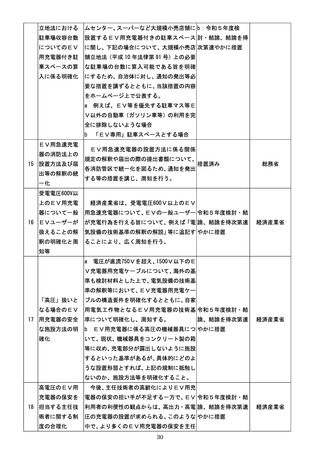
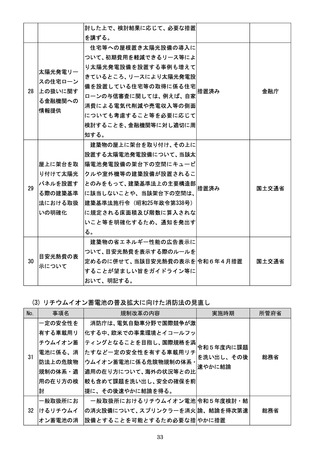
『規制改革実施計画』(令和5年6月16日閣議決定) (81 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/publication/p_index.html#program |
| 出典情報 | 令和5年 規制改革実施計画(6/16)《内閣府》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
認を少数の症例で取得している製品を利用
する場合など、保険外併用療養費制度を活用
して、患者が当該製品を利用するニーズがあ
る。このため、厚生労働省は、SaMDを使
用する患者が可能な限りその希望する医療
機関において保険外併用療養費制度等を円
滑に利用できる環境を整備するため、現行制
度について、具体的な事例も踏まえつつ、望
ましい在り方を検討する。その際、事業者が
将来的に保険収載を目指す場合であっても
利用可能な制度の在り方を検討するととも
に、事業者のニーズに応じた迅速な対象追加
が可能となる観点で検討を行う。また、可能
な限り、患者が受診する医療機関で制度利用
が可能となるよう、開発事業者と医療機関が
円滑に連携できる仕組みとすることに留意
する。
g
SaMDのうち医家向け医療機器に該当
するものについては、医療関係者以外の一般
人を対象とする広告を制限する広告規制(行
政指導)が課せられる一方で、医療機器に該
当しない機器については当該規制は課せら
れず、
「悪貨が良貨を駆逐」する状態にある
との指摘がある。これを踏まえ、厚生労働省
は、良質なSaMDへの国民のアクセスを円
滑化する観点から、一般人が利用することが
想定されるSaMDについて、単なる性能等
の情報提供にとどまらない、適正・安全に使
用するための注意事項等も含めた、一般人が
機器の選択を行うために必要な情報提供の
在り方やそれを踏まえた広告規制の要否に
ついて、検討を行う。
h
SaMDは、他の医療機器の開発と異な
り、スタートアップなどがごく少人数で開
発・生産を行う内外の実情がある一方で、我
が国では、医療機器の製造に当たり選任が必
要となる国内品質業務運営責任者(以下「品
責」という。
)の要件を満たす人材が限られ、
特に、ソフトウェア開発に関する知見を有す
る者は更に限られるとの指摘がある。このた
め、厚生労働省は、スタートアップ等による
76