よむ、つかう、まなぶ。
別紙1○【先進医療会議】先進医療Bに係る新規技術の科学的評価等について (73 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00053.html |
| 出典情報 | 先進医療会議(第117回先進医療会議、第142回先進医療技術審査部会 12/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
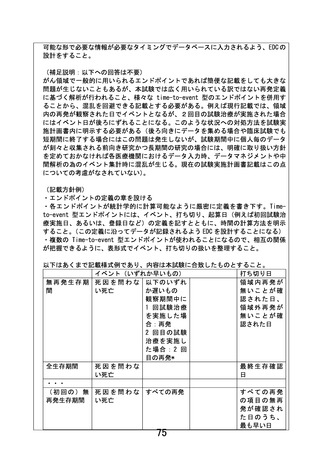
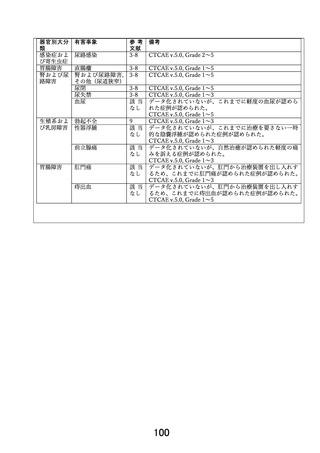
以下に2つのみ問題点を例示するが他にも問題点があり、前回照会に於いて、データ
収集方法等実施体制に関して具体的な流れを明らかにした上で改訂するよう求めたが、
対応がなされていない。適切な体制を構築したうえで、観察研究ではなく前向きの介入
研究を実施するために必要となる事項について具体的な検討を加えること無しに、本試
験実施計画書を適切に改訂することは困難であると判断せざるを得ない。
①
被験者保護の観点から現行規定の不適切な点を指摘する。試験治療に伴う合併
症・有害事象の有無を確認出来るような症例報告書(CRF)様式、症例報告書提出
方法、データマネージメント方法、データの集計方法が提示されていない。症例報
告書一式内に「有害事象症例報告書(Ⅰ)~(Ⅲ)」の様式があるが、いつ提出する
のかが定められていない。これは、試験治療実施時の各事象の有無を全例で(有害
事象がない症例も含めて)記録を必須とし、速やかに提出するよう定め、それを適
宜処理できる体制を構築する必要がある。
② 本試験では 1 年目に 90 名、2 年目に 120 名の登録を見込んでおり 3 年で合計 310
名が登録される。しかしながら、前項以外についても、症例報告書(CRF)の各様
式の提出の〆切が明示されていないなど、具体的にデータ収集体制が構築されてい
ない。
「臨床検査記録 その2」に至ってはいつのデータを記載するのかが不明確で
あり、かつ、様式に記載した日付すら把握出来ない形となっている。仮に全 CRF が
記載できるタイミングで即記載され提出されるとすると、2 年目には 1100 冊以上、
4800 ページ弱の症例報告書が五月雨で日々申請医療機関の研究責任医師にメール
されることになる。これを確認し、データ入力し、データの不整合を確認して担当
医に問い合わせを行い、再発イベントの有無を判断するために必要な情報を症例ご
とに精査し、解析出来るようにデータを整理する作業を行うことになるが、改訂案
はそのプロセスを具体的に想定して定められているとは解釈出来ない。
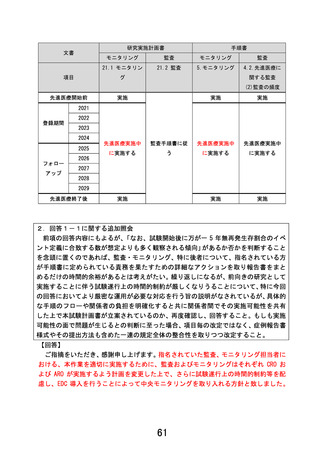
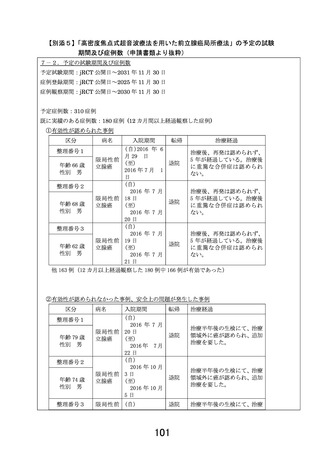
【回答】
回答3-1への回答後に症例報告書(CRF)様式、データ収集方式を EDC を用いる様
式に計画書を修正いたしました。これに伴いまして、CRF の記載は EDC データ収集にお
けるフォーム例として提示することと致しました。
本研究において、研究の進捗状況、特に再発イベント発生の現状を多施設共同研究者
が把握することが重要であるため、イベントの定義を明確にするとともに、EDC を用い
て遅滞なくデータ入力できるよう、手順を作成し各研究者にトレーニングを行います。
その上で、中央モニタリングを導入して適切な間隔で症例集積状況とイベント発生数
を各研究者にレポートを行います。中間解析に近づいた場合は、各施設にリマインドを
行い、事務局と連携の上で症例登録などを進める手順も定めることと致します。
なお、再発イベントに関して重篤有害事象例や死亡例に準じて、アラート機能を用いる
ことができるかどうかに関しても、現状構築中の EDC にて工夫を検討する予定として
おります。
以上
73
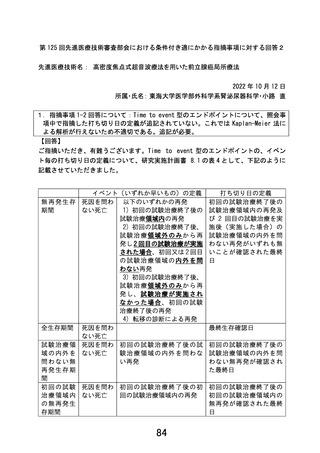
収集方法等実施体制に関して具体的な流れを明らかにした上で改訂するよう求めたが、
対応がなされていない。適切な体制を構築したうえで、観察研究ではなく前向きの介入
研究を実施するために必要となる事項について具体的な検討を加えること無しに、本試
験実施計画書を適切に改訂することは困難であると判断せざるを得ない。
①
被験者保護の観点から現行規定の不適切な点を指摘する。試験治療に伴う合併
症・有害事象の有無を確認出来るような症例報告書(CRF)様式、症例報告書提出
方法、データマネージメント方法、データの集計方法が提示されていない。症例報
告書一式内に「有害事象症例報告書(Ⅰ)~(Ⅲ)」の様式があるが、いつ提出する
のかが定められていない。これは、試験治療実施時の各事象の有無を全例で(有害
事象がない症例も含めて)記録を必須とし、速やかに提出するよう定め、それを適
宜処理できる体制を構築する必要がある。
② 本試験では 1 年目に 90 名、2 年目に 120 名の登録を見込んでおり 3 年で合計 310
名が登録される。しかしながら、前項以外についても、症例報告書(CRF)の各様
式の提出の〆切が明示されていないなど、具体的にデータ収集体制が構築されてい
ない。
「臨床検査記録 その2」に至ってはいつのデータを記載するのかが不明確で
あり、かつ、様式に記載した日付すら把握出来ない形となっている。仮に全 CRF が
記載できるタイミングで即記載され提出されるとすると、2 年目には 1100 冊以上、
4800 ページ弱の症例報告書が五月雨で日々申請医療機関の研究責任医師にメール
されることになる。これを確認し、データ入力し、データの不整合を確認して担当
医に問い合わせを行い、再発イベントの有無を判断するために必要な情報を症例ご
とに精査し、解析出来るようにデータを整理する作業を行うことになるが、改訂案
はそのプロセスを具体的に想定して定められているとは解釈出来ない。
【回答】
回答3-1への回答後に症例報告書(CRF)様式、データ収集方式を EDC を用いる様
式に計画書を修正いたしました。これに伴いまして、CRF の記載は EDC データ収集にお
けるフォーム例として提示することと致しました。
本研究において、研究の進捗状況、特に再発イベント発生の現状を多施設共同研究者
が把握することが重要であるため、イベントの定義を明確にするとともに、EDC を用い
て遅滞なくデータ入力できるよう、手順を作成し各研究者にトレーニングを行います。
その上で、中央モニタリングを導入して適切な間隔で症例集積状況とイベント発生数
を各研究者にレポートを行います。中間解析に近づいた場合は、各施設にリマインドを
行い、事務局と連携の上で症例登録などを進める手順も定めることと致します。
なお、再発イベントに関して重篤有害事象例や死亡例に準じて、アラート機能を用いる
ことができるかどうかに関しても、現状構築中の EDC にて工夫を検討する予定として
おります。
以上
73