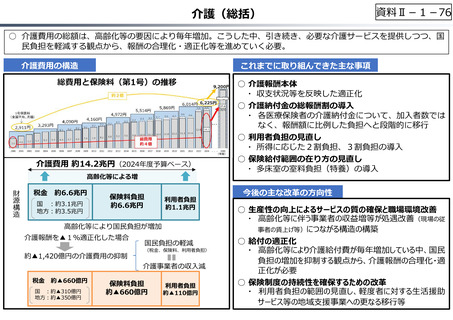
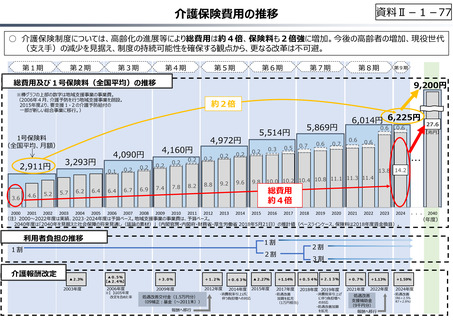
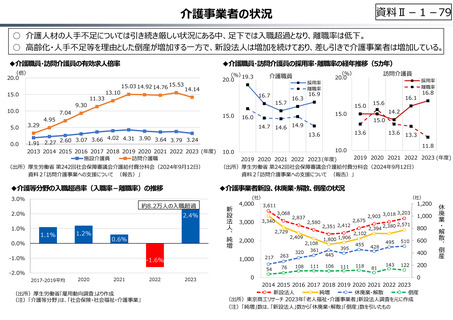
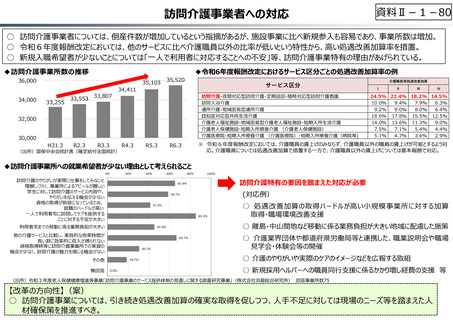
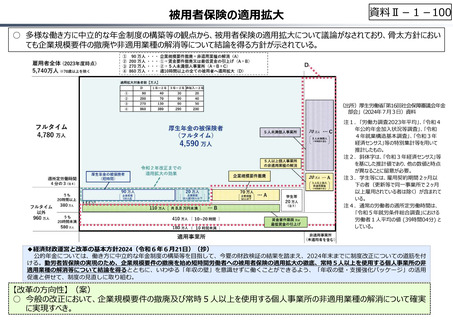
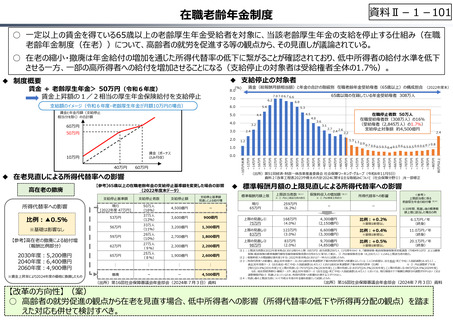
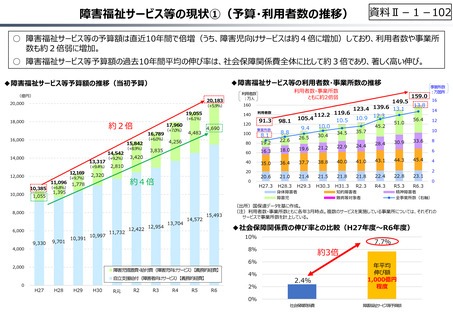
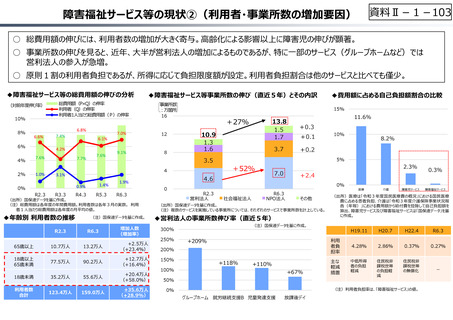
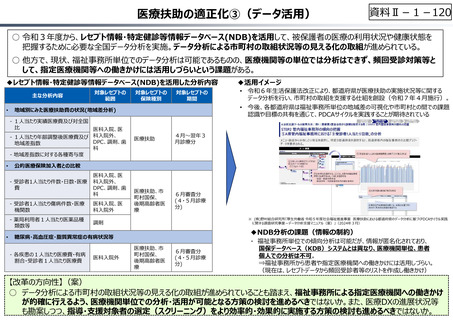
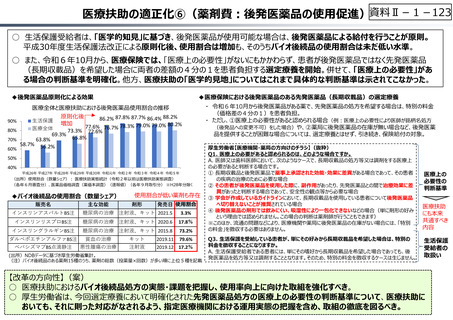
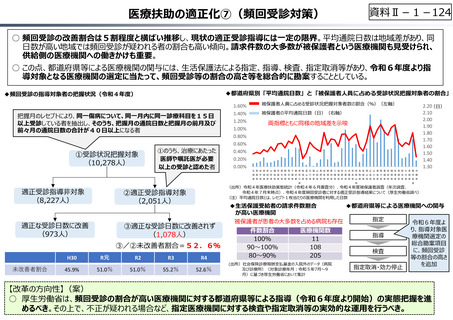
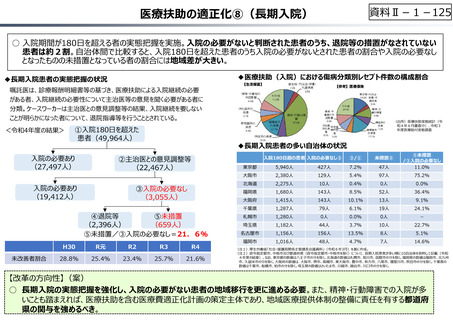
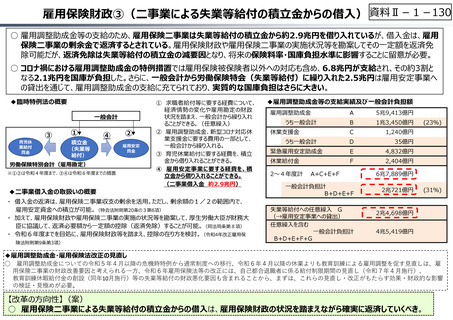
資料 Ⅱ-1-1 2025年度予算編成における課題 (17 ページ)
出典
| 公開元URL | https://www.mof.go.jp/about_mof/councils/fiscal_system_council/sub-of_fiscal_system/report/zaiseia20241129/index.html |
| 出典情報 | 令和7年度予算の編成等に関する建議(11/29)《財務省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
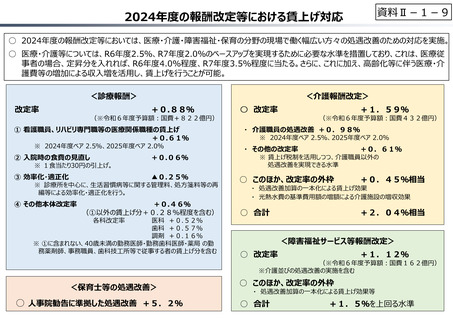
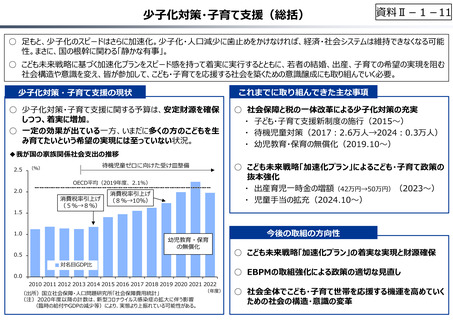
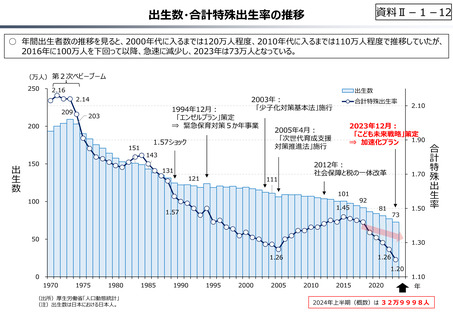
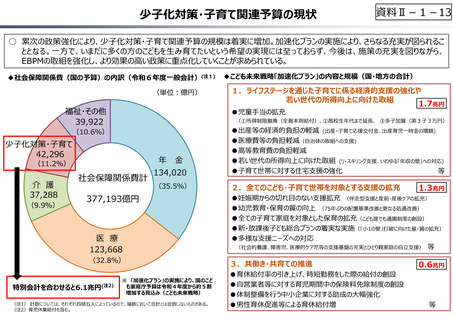
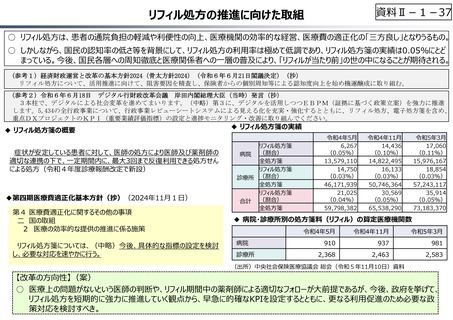
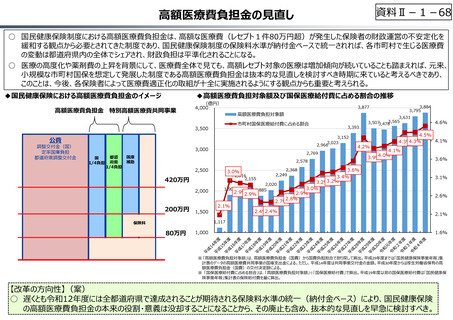
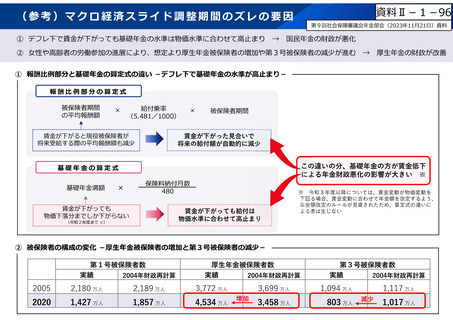
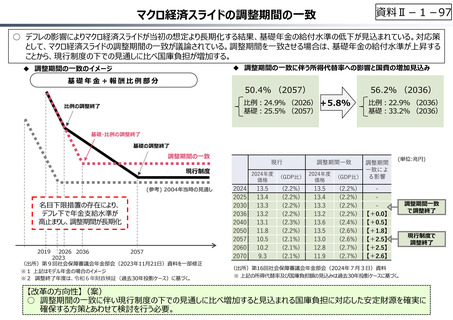
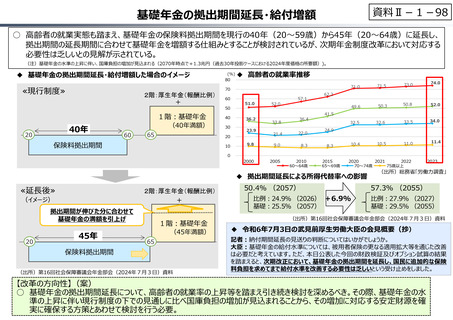
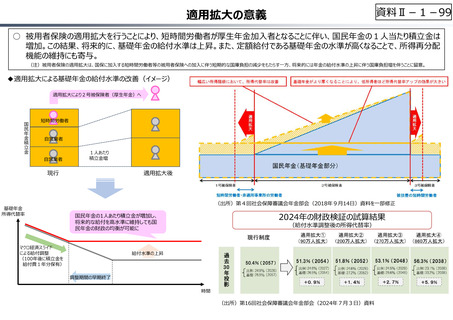
資料Ⅱ-1-17
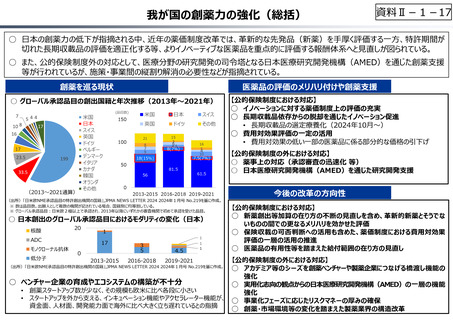
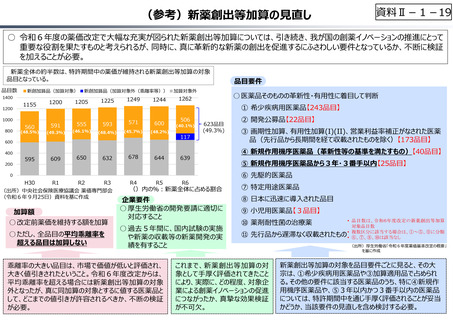
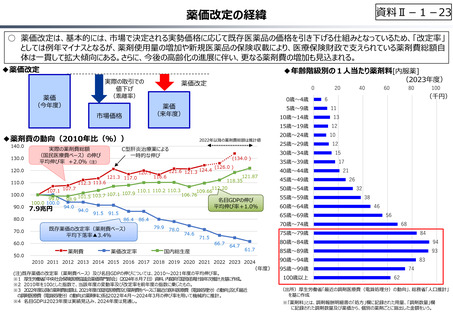
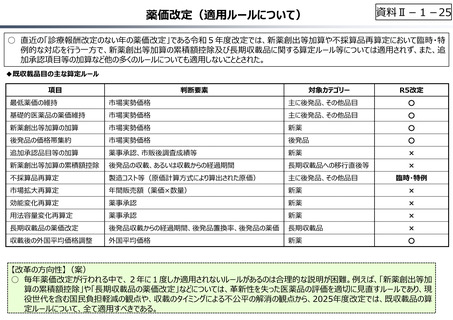
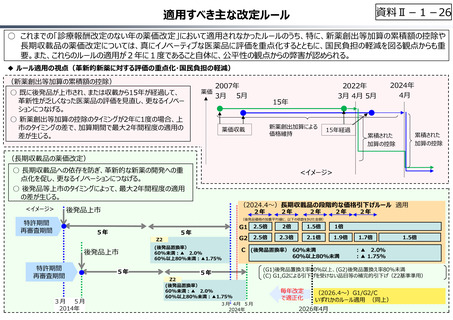
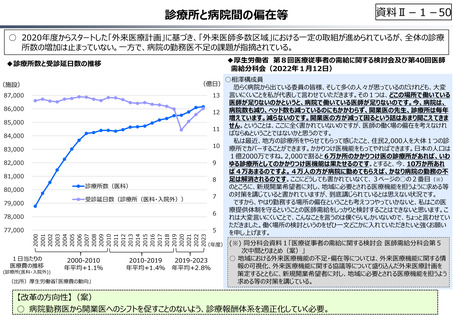
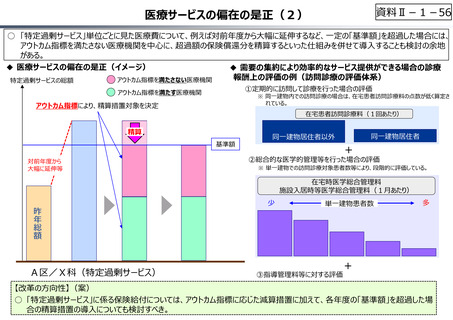
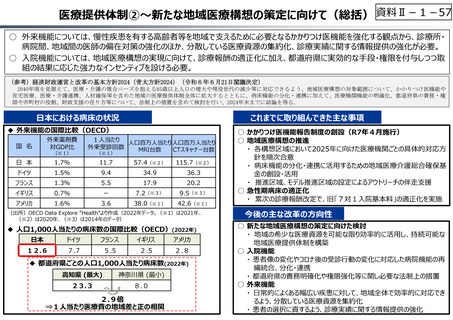
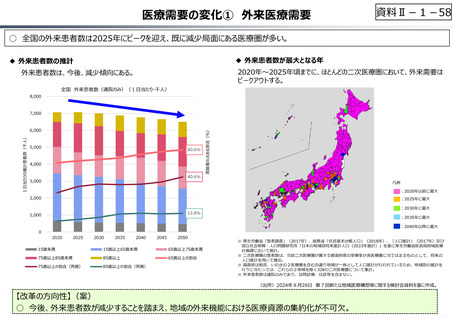
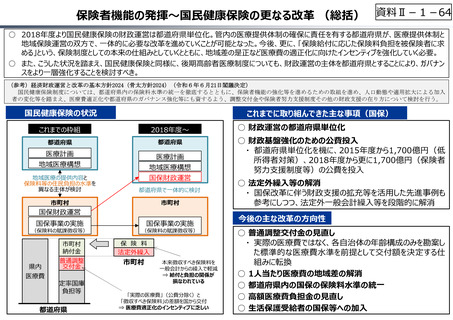
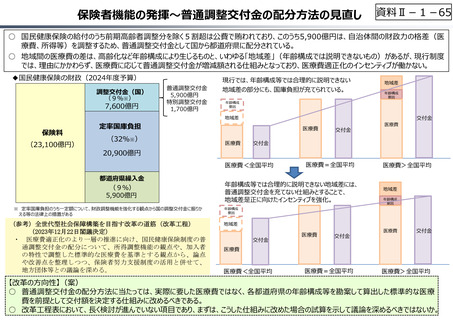
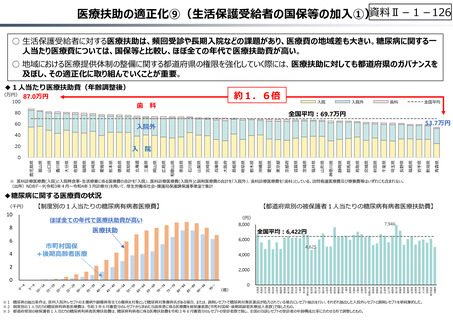
○ 日本の創薬⼒の低下が指摘される中、近年の薬価制度改⾰では、⾰新的な先発品(新薬)を⼿厚く評価する一⽅、特許期間が
切れた⻑期収載品の評価を適正化する等、よりイノベーティブな医薬品を重点的に評価する報酬体系へと⾒直しが図られている。
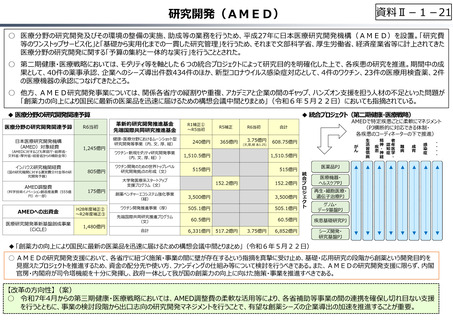
○ また、公的保険制度外の対応として、医療分野の研究開発の司令塔となる日本医療研究開発機構(AMED)を通じた創薬⽀援
等が⾏われているが、施策・事業間の縦割り解消の必要性などが指摘されている。
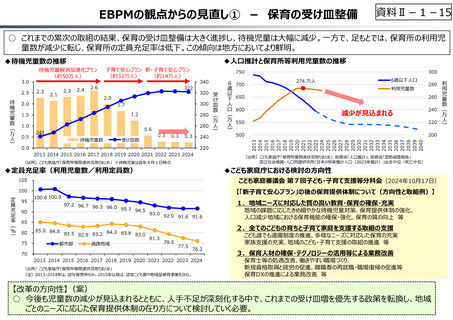
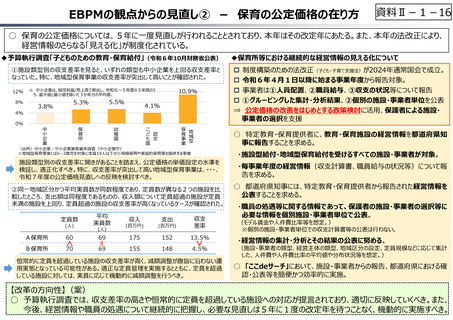
創薬を巡る現状
医薬品の評価のメリハリ付けや創薬支援
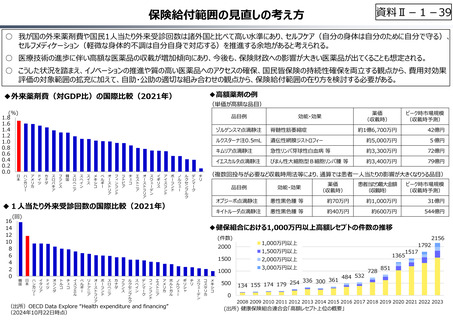
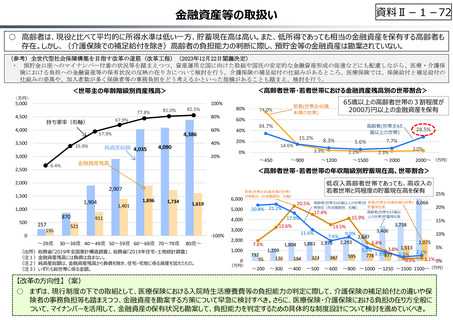
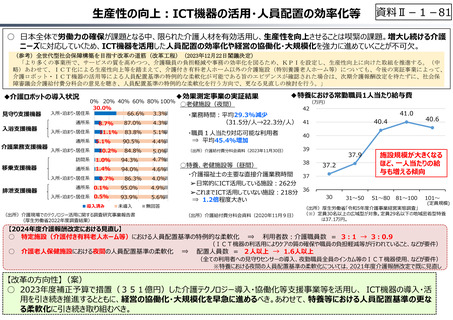
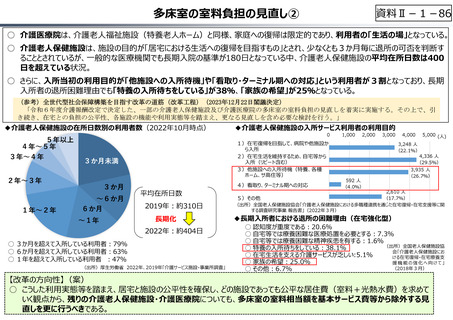
○ グローバル承認品目の創出国籍と年次推移(2013年〜2021年)
7
544
10 8
16
17
17
23.5
199
33.5
(2013〜2021通算)
(品目数)
米国
日本
スイス
英国
ドイツ
ベルギー
デンマーク
イタリア
カナダ
韓国
オランダ
その他
米国
日本
スイス
英国
ドイツ
その他
21
15
3
6
4.5
150
100
8
7
9
8(7%)
4
10
7.5(7%)
18(15%)
50
16
5
81.5
56
61.5
0
2013-2015 2016-2018 2019-2021
(出所)「日米欧NME承認品目の特許創出機関の国籍」,JPMA NEWS LETTER 2024 2024年1月号 No.219を基に作成。
※ 数は品目数。出願人として複数の機関が記されている場合、国籍別に均等割している。
※ グローバル承認品目︓日米欧2極以上で承認され、2013年以降にいずれかの審査機関で初めて承認を受けた品目。
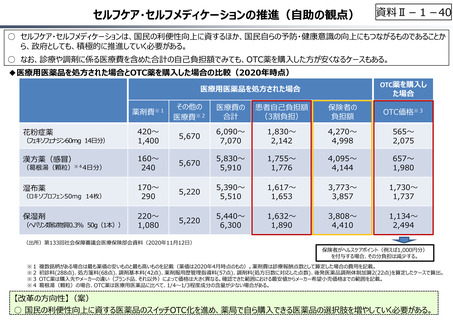
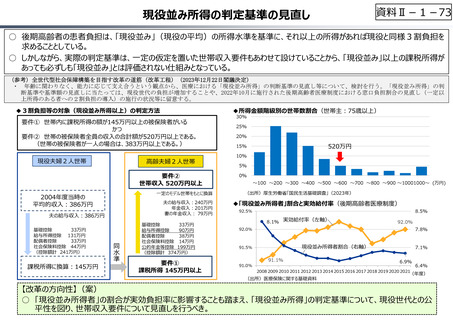
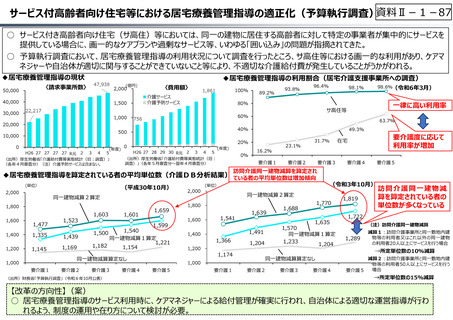
○ 日本創出のグローバル承認品目におけるモダリティの変化(日本)
核酸
20
ADC
モノクローナル抗体
低分子
1
17
0
1
3
5
4.5
1
1
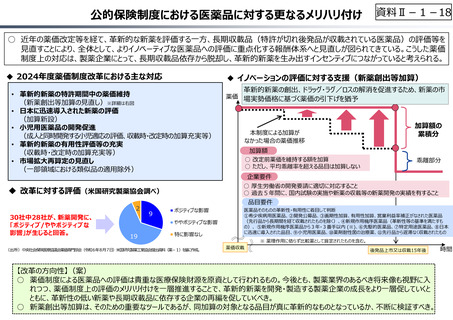
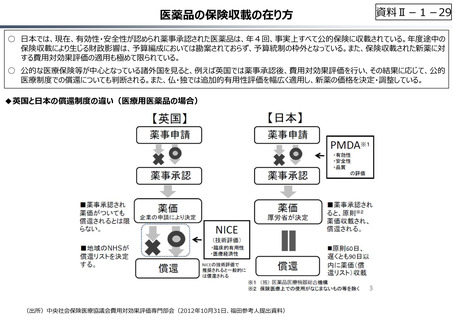
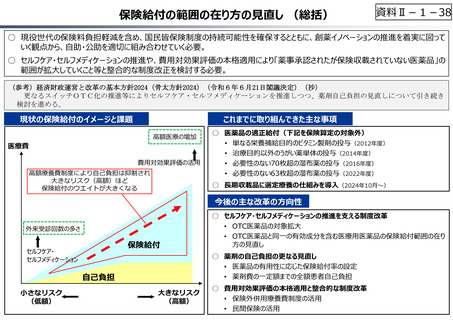
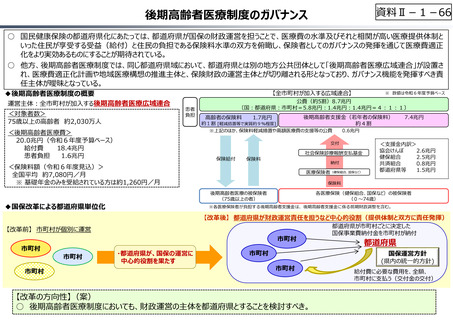
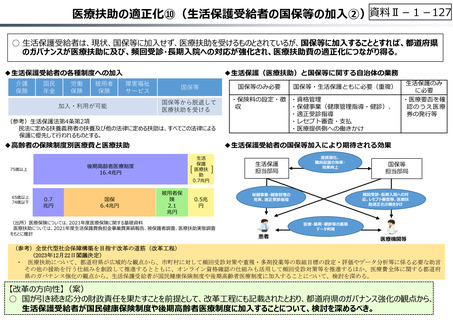
【公的保険制度における対応】
⃝ イノベーションに対する薬価制度上の評価の充実
⃝ ⻑期収載品依存からの脱却を通じたイノベーション促進
• ⻑期収載品の選定療養化(2024年10月〜)
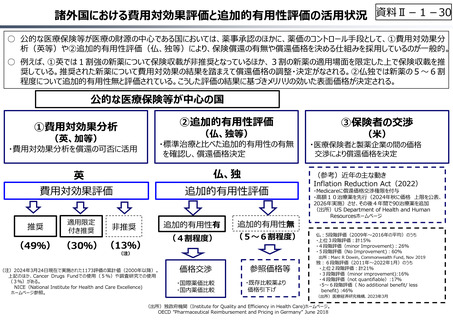
⃝ 費用対効果評価の⼀定の活用
• 費用対効果の低い一部の医薬品に係る部分的な価格の引下げ
【公的保険制度の外における対応】
○ 薬事上の対応(承認審査の迅速化 等)
○ 日本医療研究開発機構(AMED)を通じた研究開発支援
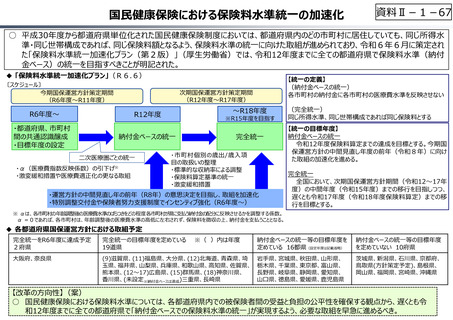
今後の改革の方向性
【公的保険制度における対応】
⃝ 新薬創出等加算の在り方の不断の⾒直しを含め、革新的新薬とそうでな
いものの間での更なるメリハリを効かせた評価
⃝ 保険収載の可否判断への活用も含めた、薬価制度における費用対効果
評価の⼀層の活用の推進
⃝ 医薬品の有用性等を踏まえた給付範囲の在り方の⾒直し
【公的保険制度の外における対応】
⃝ アカデミア等のシーズを創薬ベンチャーや製薬企業につなげる橋渡し機能の
強化
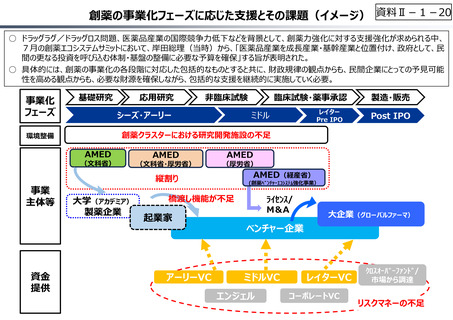
○ ベンチャー企業の育成やエコシステムの構築が不⼗分
⃝ 実用化志向の観点からの日本医療研究開発機構(AMED)の⼀層の機能
• 創薬スタートアップ数が少なく、その規模も欧米に⽐べ各段に⼩さい
強化
• スタートアップを外から⽀える、インキュベーション機能やアクセラレーター機能が、 ⃝ 事業化フェーズに応じたリスクマネーの厚みの確保
資⾦⾯、人材⾯、開発能⼒⾯で海外に⽐べ大きく⽴ち遅れているとの指摘
⃝ 創薬・市場環境等の変化を踏まえた製薬業界の構造改革
2013-2015
2016-2018
2019-2021
(出所)「日米欧NME承認品目の特許創出機関の国籍」,JPMA NEWS LETTER 2024 2024年1月号 No.219を基に作成。