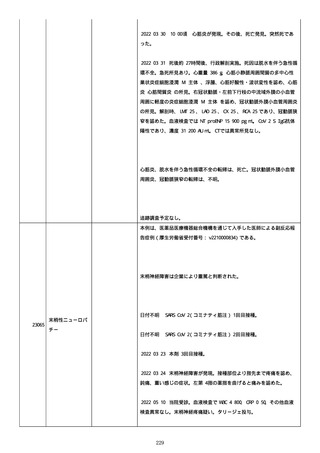
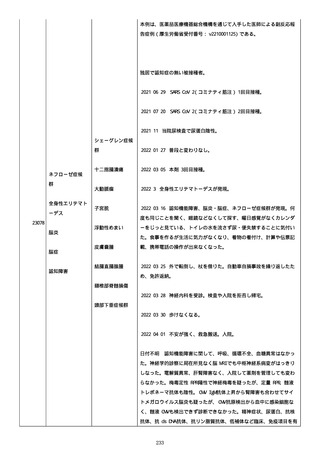
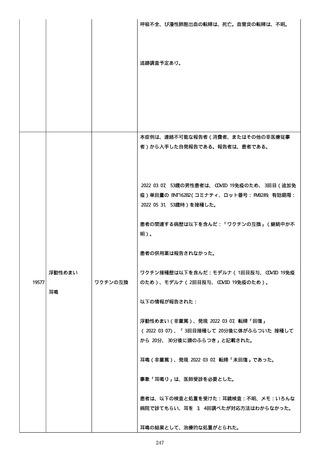
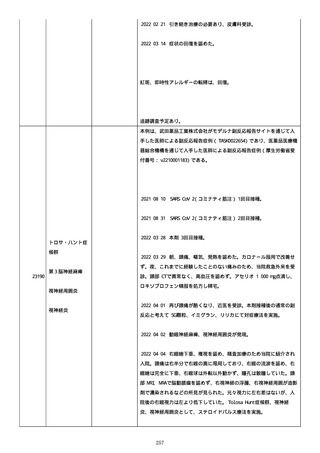
資料1-2-3-6 薬機法に基づく製造販売業者からの副反応疑い報告状況について(交互接種に係る報告症例・基礎疾患等及び症例経過 (274 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00046.html |
| 出典情報 | 第82回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第8回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(8/5)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
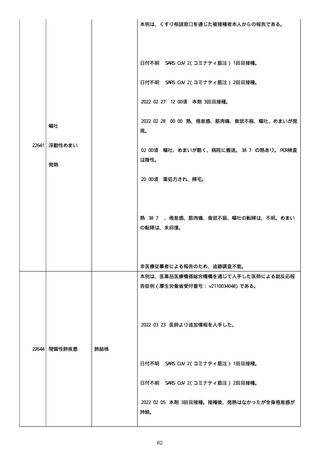
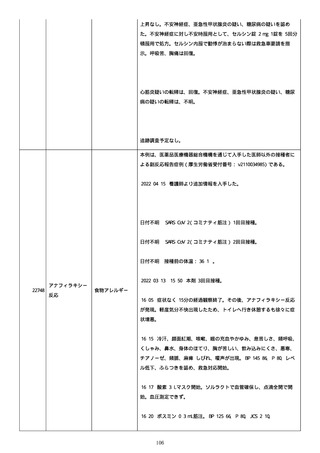
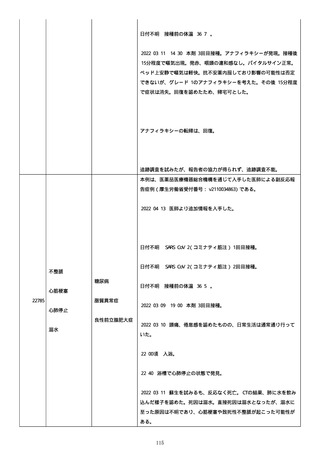
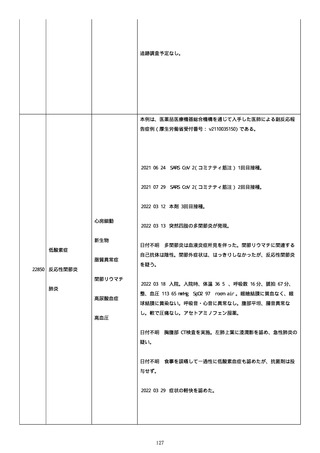
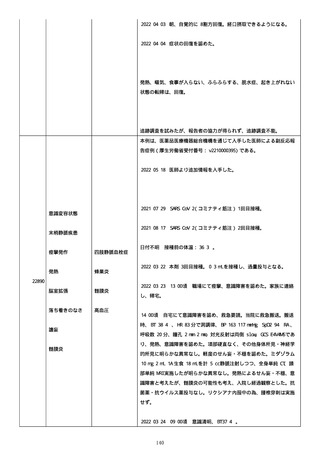
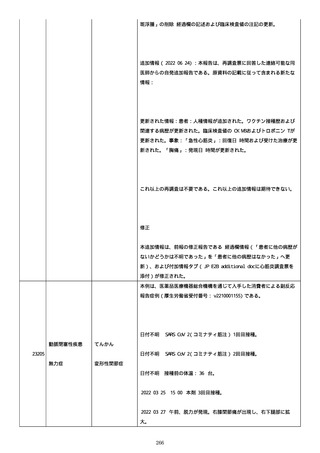
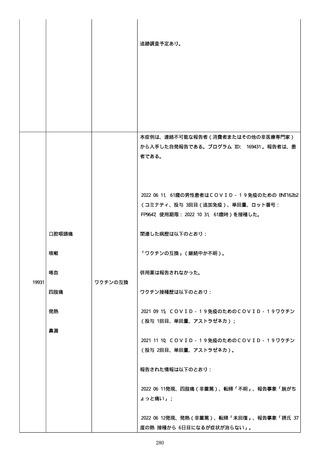
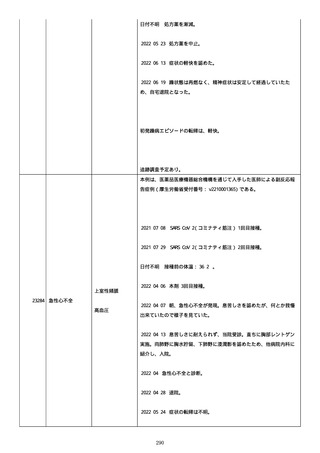
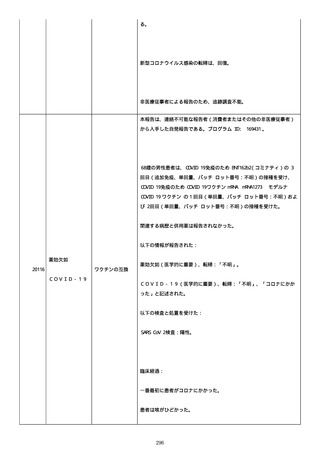
のため、今後抗体価の下がりが悪ければアザチオプリンも考慮。以降、
抗体価は減少傾向。臨床上も上皮化傾向のため 2 週間毎に 5 mg ずつ減
量。
2022/05/16 マグミット投与開始。
2022/05/17
PDAI は皮膚 9 点、頭皮 0 点、粘膜 6 点の計 15 点。
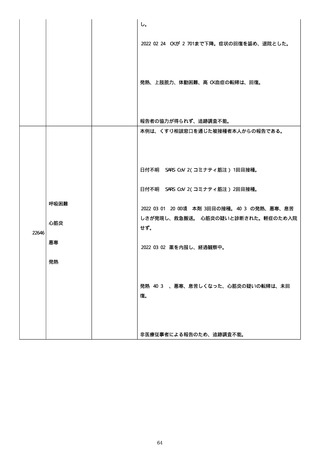
2022/05/18 ボナロン 35 mg(水)投与開始。
2022/05/23 血液検査実施し、腎機能改善、肝機能横ばい、糖尿病は良
好、脂質問題なし。ケトコナ終了。
2022/05/24 腰痛の訴えあり。胸椎から腰椎に叩打痛を認めた。左背部
も圧痛を認めた。安静時痛なし。CVA 叩打痛なし。MRI で特に問題なくロ
キソニンテープで対応。血糖値は概ね 100 台で安定しており、プレドニ
ンも減量するため血糖測定及びスライディングスケール終了。
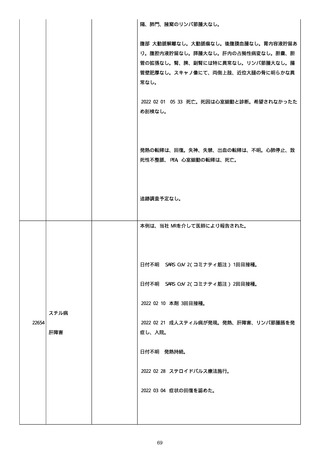
2022/05/25 プレドニゾロン 45 mg に漸減。
2022/05/26 舌の白色部位のカンジダは鏡検で陰性、陰部もカンジダを
疑う所見なし。
2022/05/28 マグミット増量。
2022/05/30 血液検査実施し、肝腎機能横ばい、IgG 正常値、CMV やや低
下。
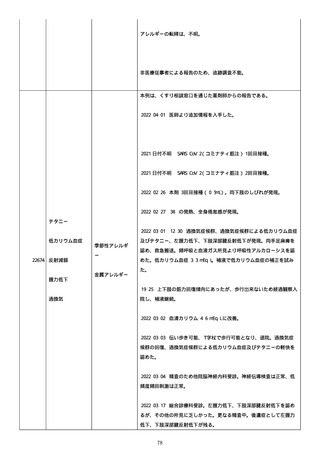
2022/06/01
PDAI は皮膚 3 点、頭皮 0 点、粘膜 3 点の計 6 点。
2022/06/06 血液検査実施し、FDP、DD 上昇、肝酵素軽度上昇、CMV は減
少傾向。
2022/06/08 プレドニゾロン 40 mg に漸減。PDAI は皮膚 1 点、頭皮 0
点、粘膜 2 点の計 3 点。
日付不明
ロスバスタチン 2.5 mg、ファモチジン 20 mg、マグミット
660 mg、バクダ 3 錠(月水金)、ボナロン 35 mg(水)内服中。体温
36.5℃、血圧 102/57 mmHg、SpO2 97%、HR 61/分。顔面の右眼下頬部に
硬貨大のびらんが上皮化。口腔内の硬口蓋には認めないが軟口蓋全体的
274