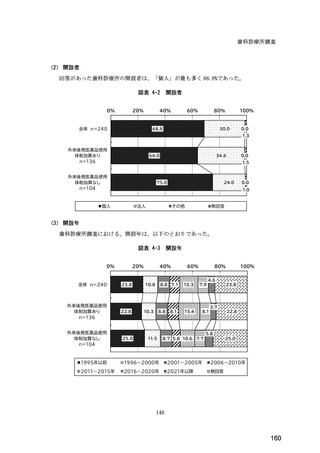
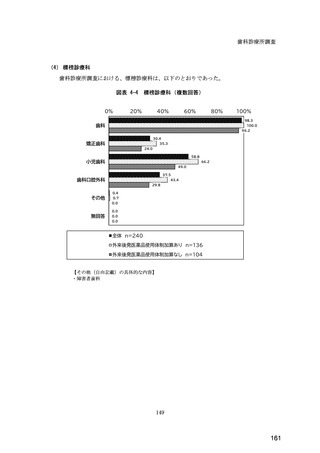
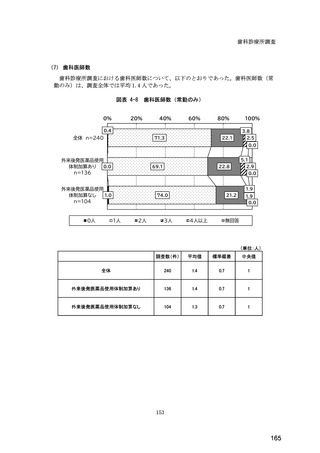
検-3-2令和6年度診療報酬改定の結果検証に係る特別調査(令和6年度調査)の報告案について (295 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_56721.html |
| 出典情報 | 中央社会保険医療協議会 診療報酬改定結果検証部会(第72回 4/9)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
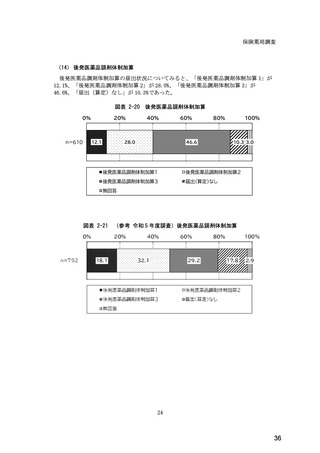
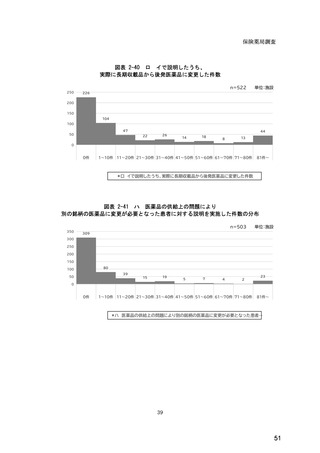
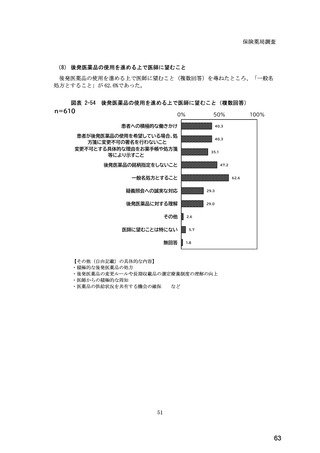
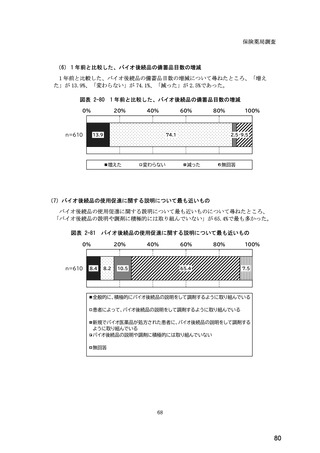
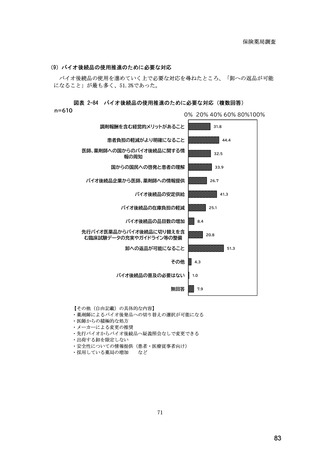
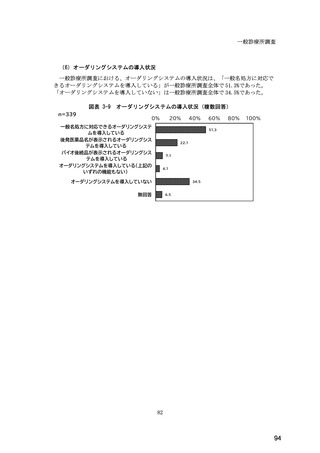
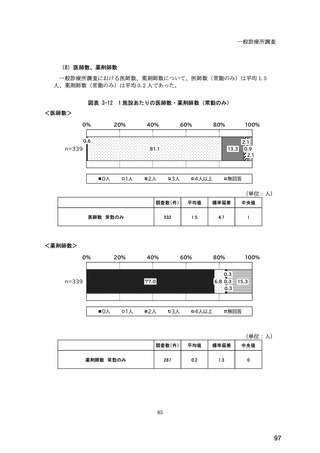
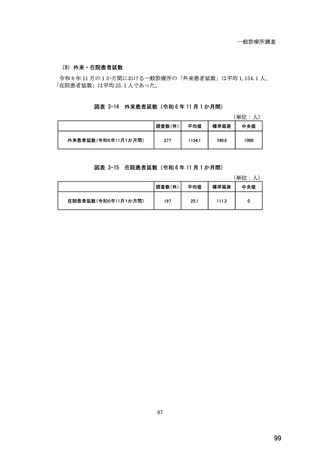
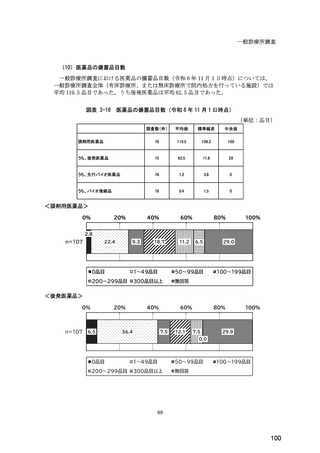
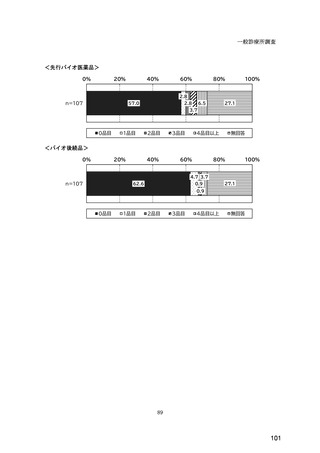
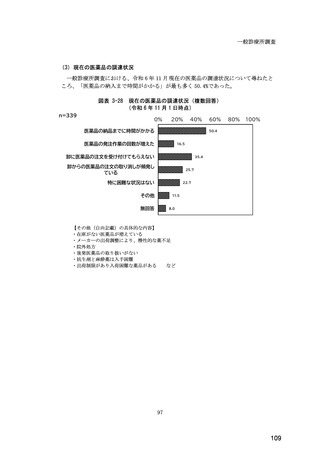
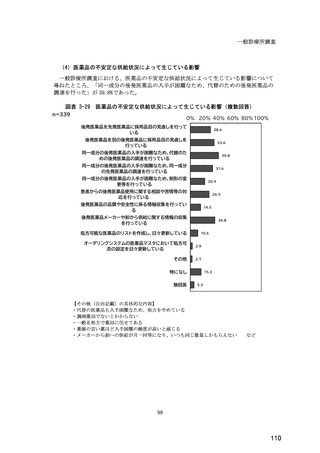
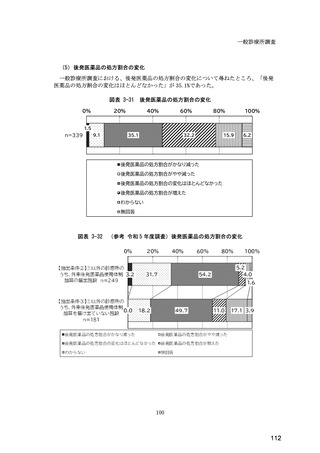
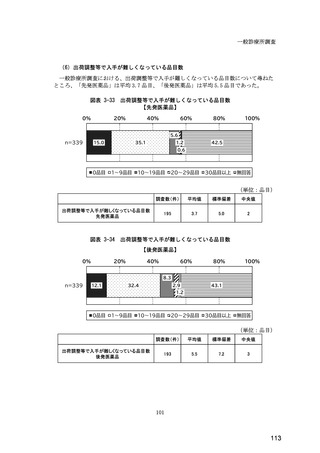
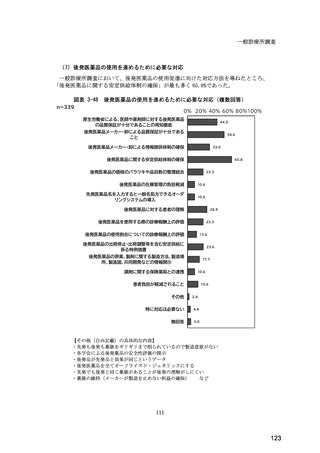
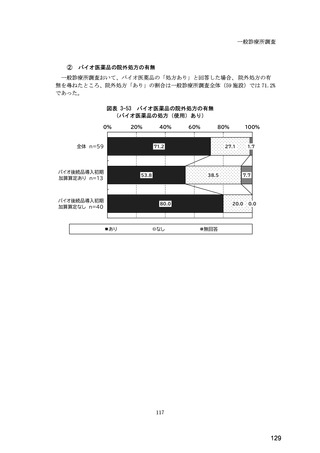
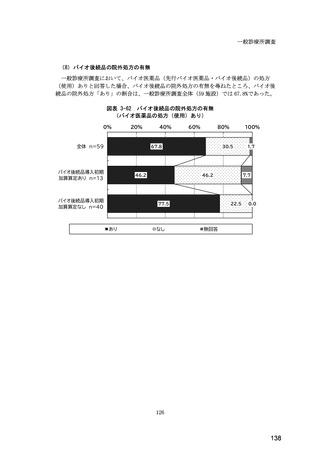
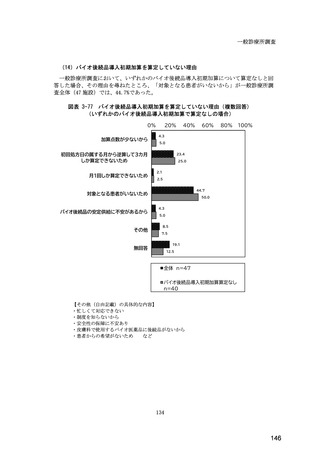
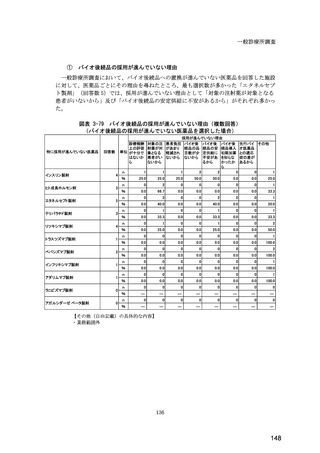
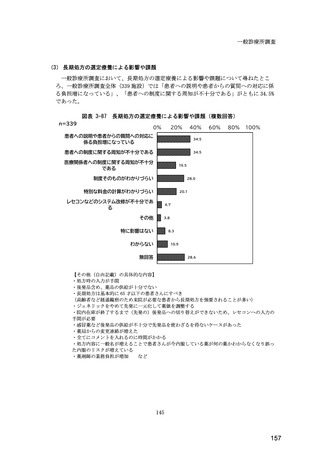
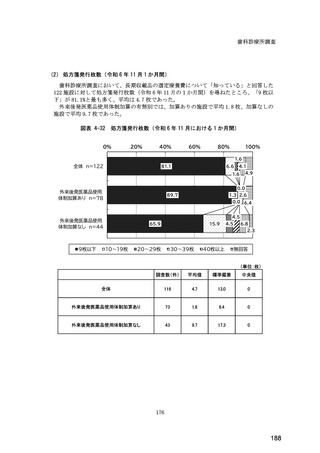
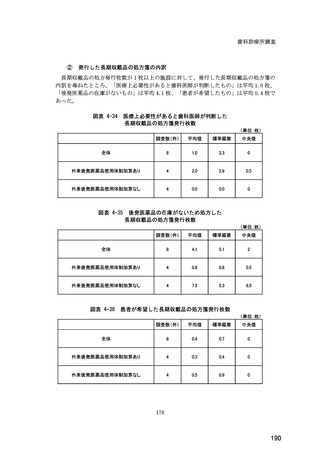
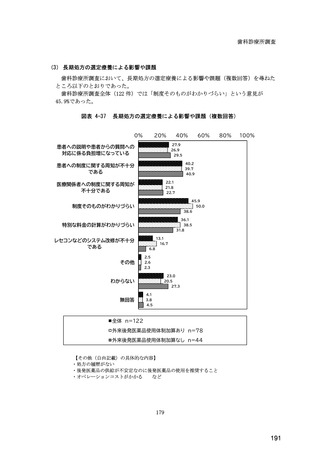
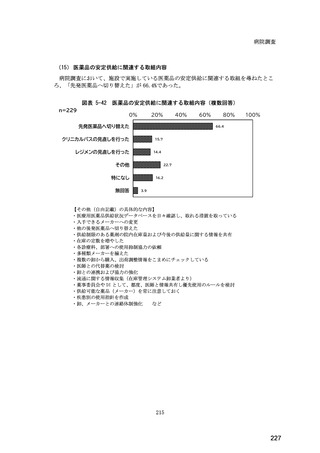
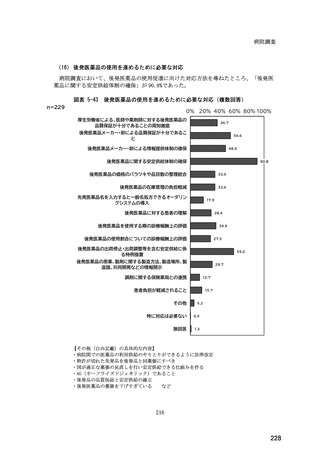
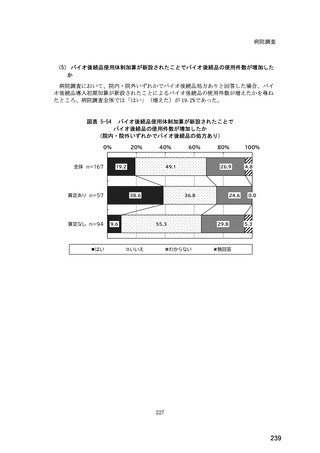
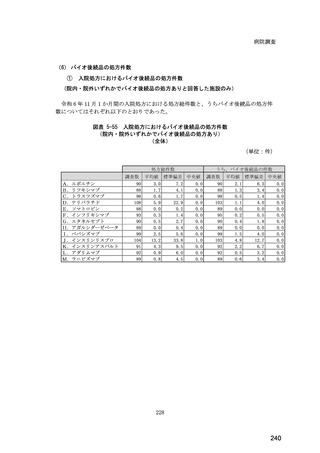
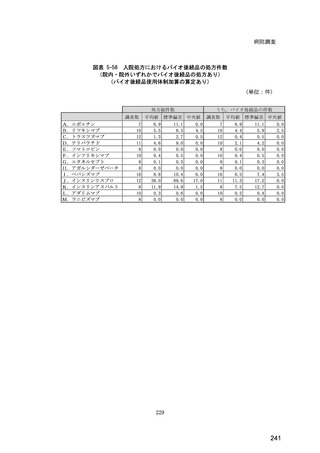
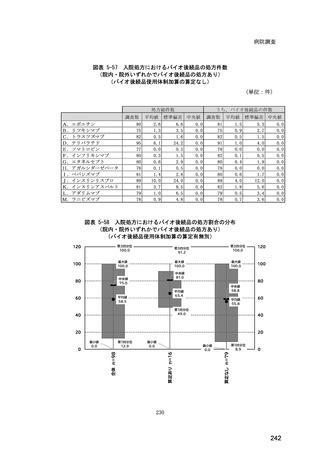
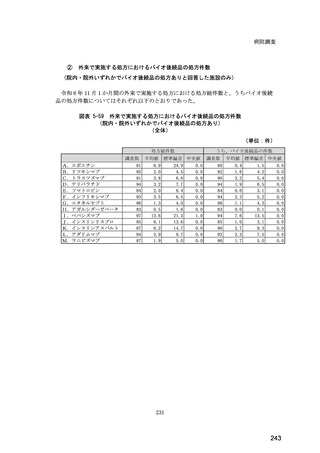
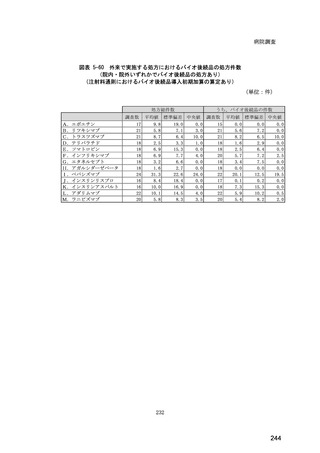
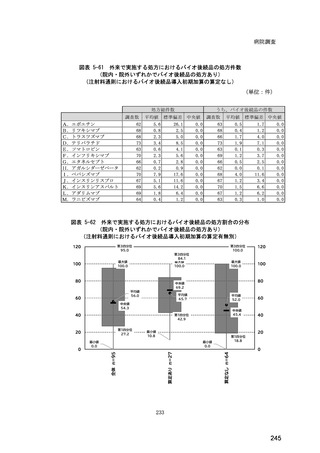
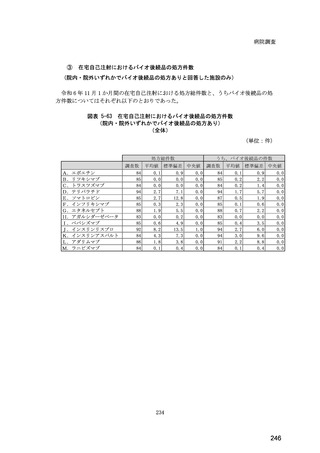
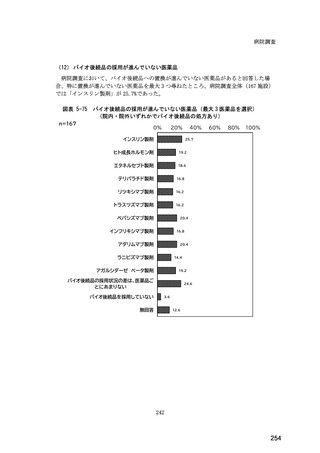
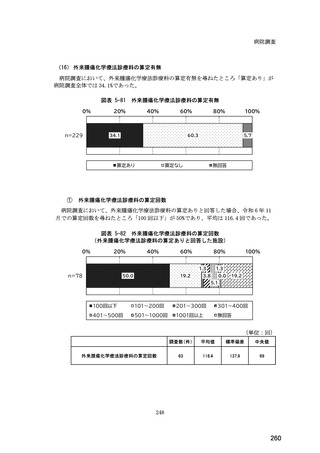
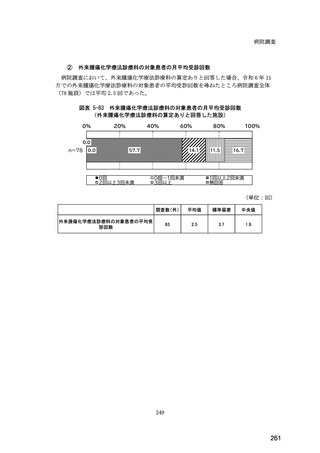
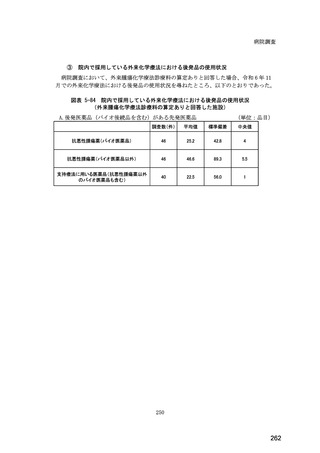
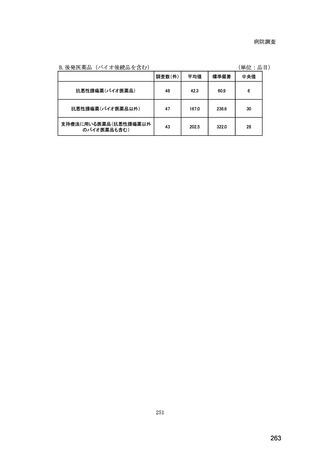
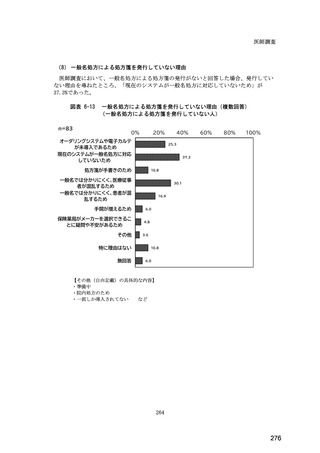
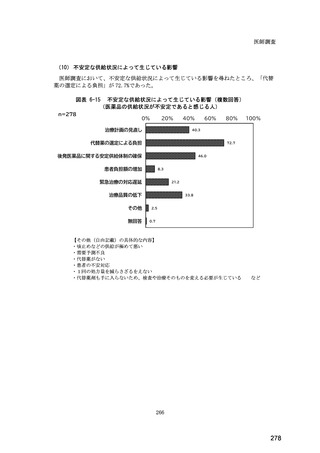
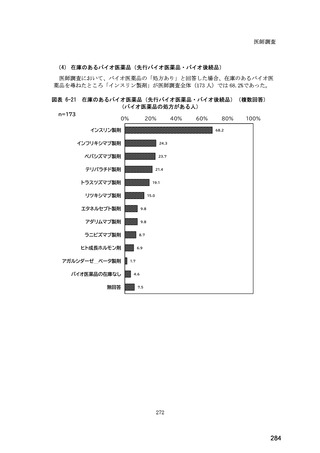
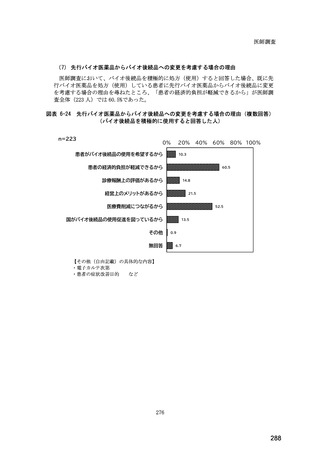
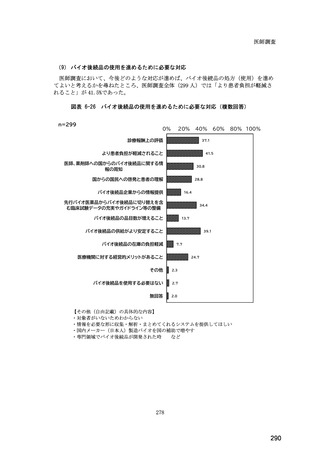
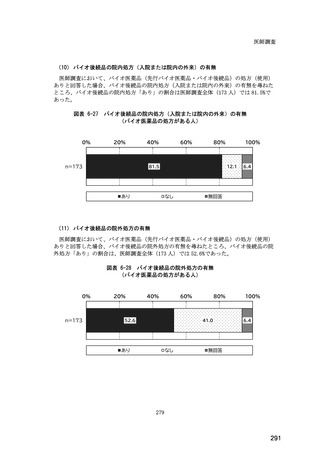
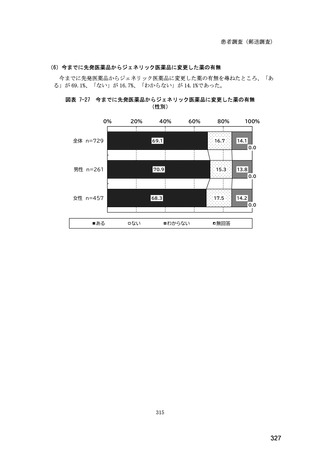
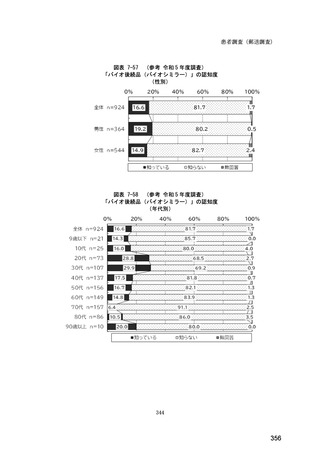
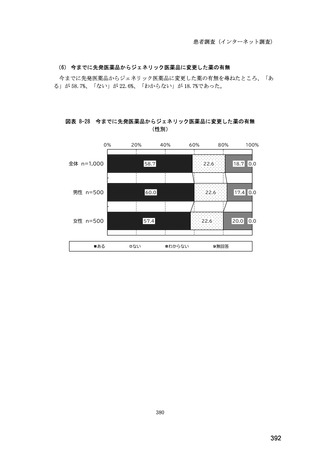
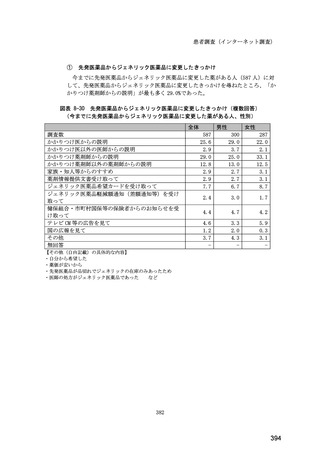
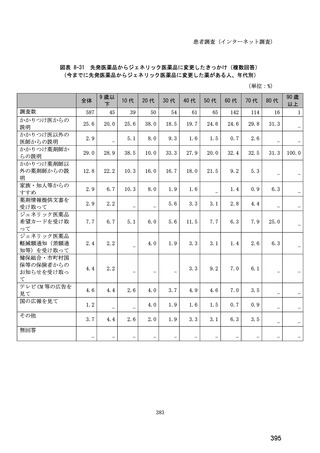
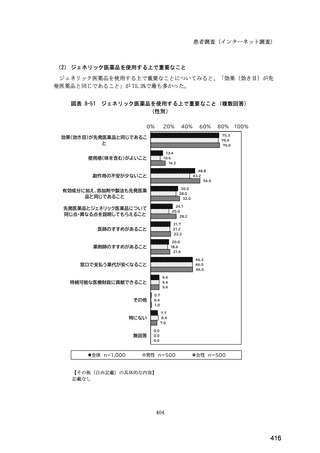
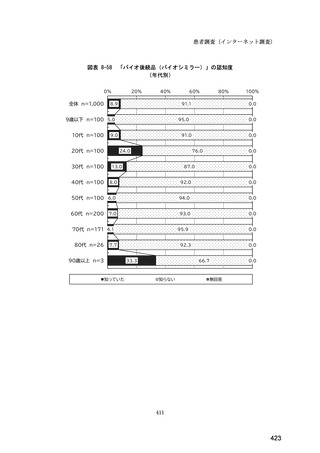
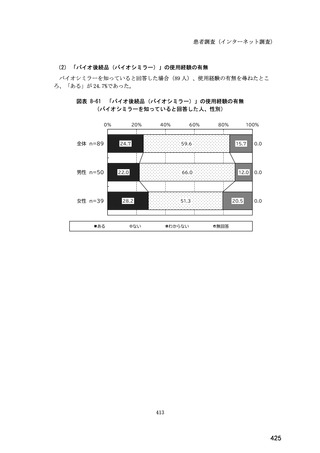
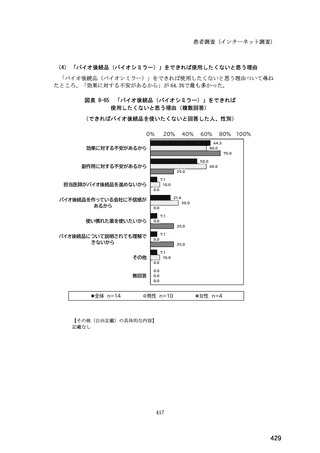
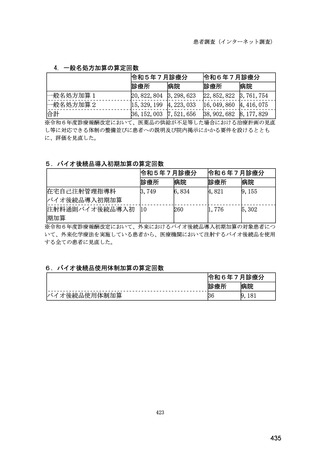
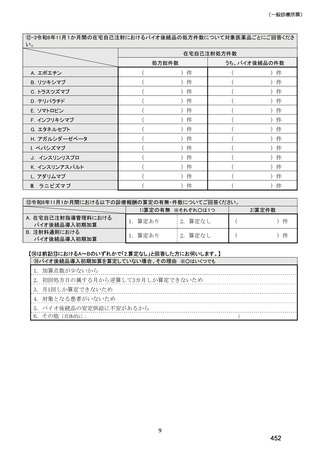
(14) バイオ後続品の院外処方の際の、処方箋への表記方法
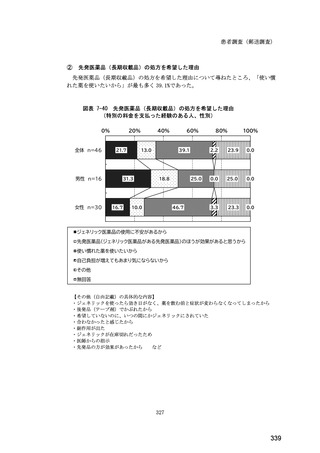
医師調査において、バイオ後続品の院外処方ありと回答した場合、バイオ後続品の院外
処方箋の表記を尋ねたところ、「バイオ後続品の販売名(例:「●●● BS 注射液 含量
会社名」)」が医師調査全体(91 人)では 51.6%であった。
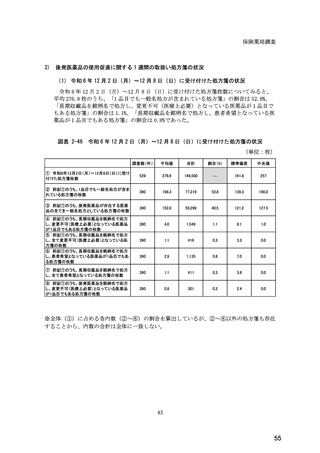
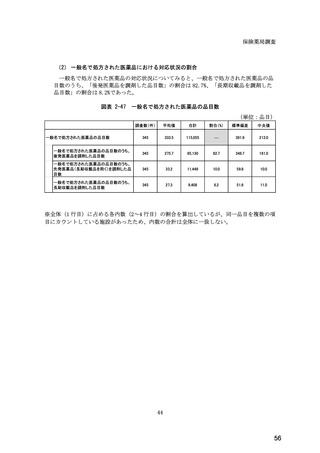
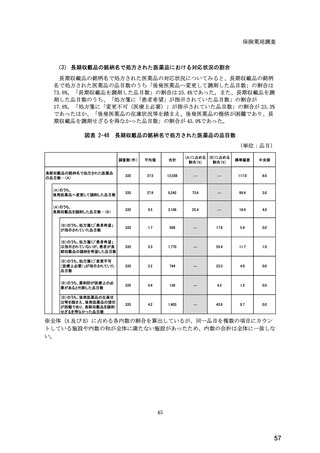
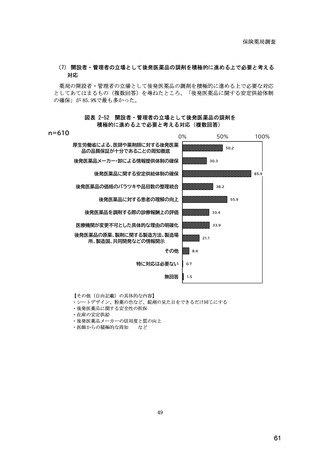
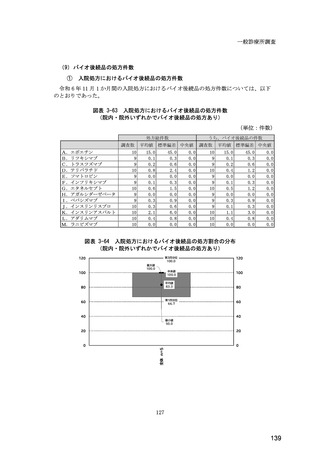
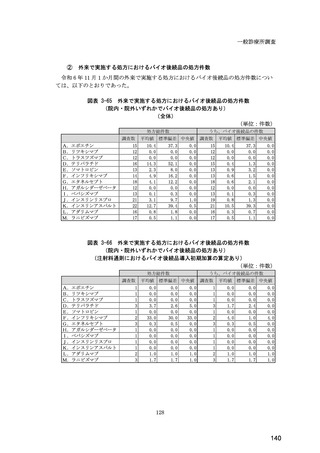
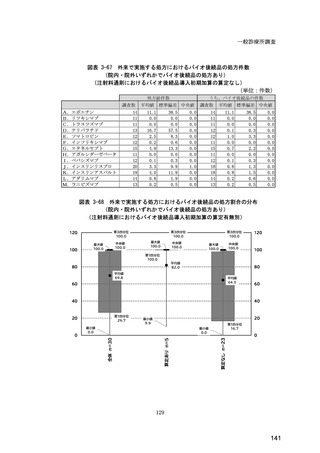
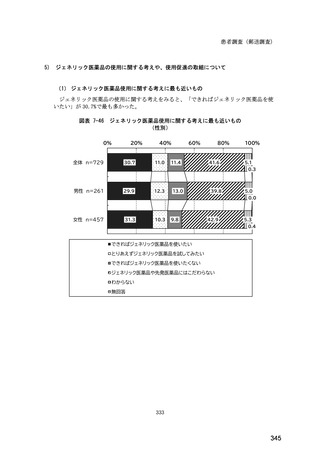
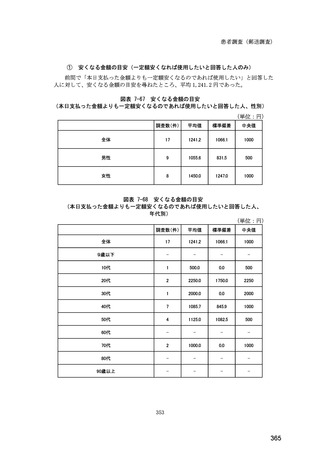
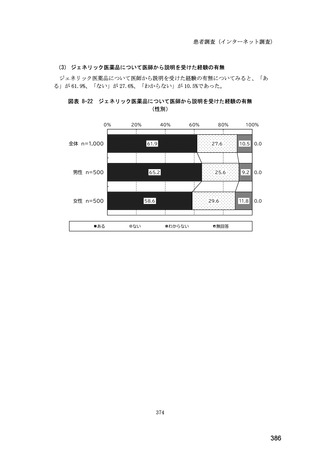
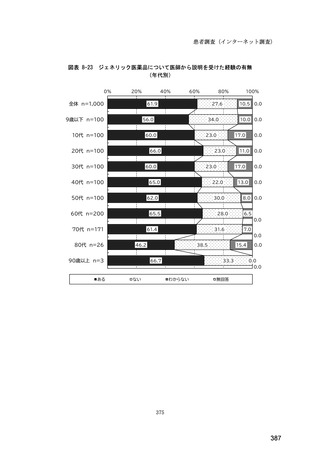
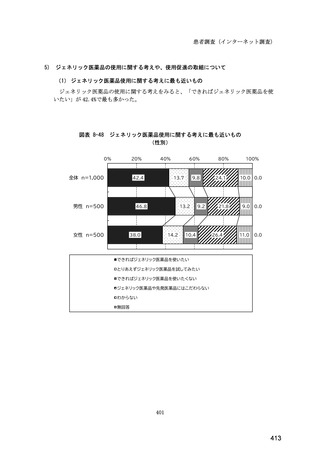
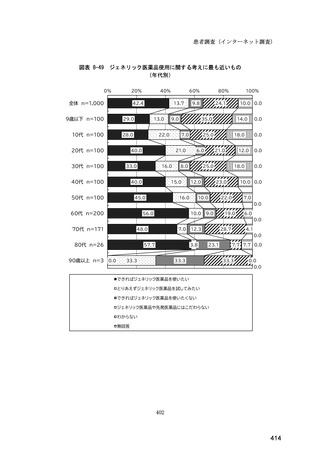
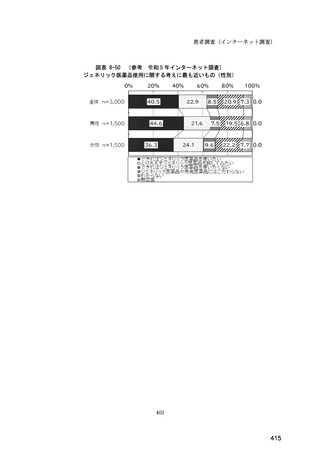
図表 6-31 バイオ後続品の院外処方の際の、処方箋への表記方法
(バイオ後続品の処方がある人)
0%
20%
40%
60%
80%
100%
5.5
n=91
51.6
16.5
7.7
11.0
4.4
3.3
バイオ後続品の販売名(例:「●●●_BS注射液_含量_会社名」)
バイオ後続品の一般的名称(「○○○(遺伝子組換え)[●●●後続1]」)
バイオ後続品の一般的名称だが(遺伝子組換え)と記載しない(「○○○[●●●
後続1]」)
変更不可欄にチェックを入れずに先行品の販売名で処方
変更不可欄にチェックを入れずに先行品の一般的名称で処方(「○○○(遺伝子
組換え))
その他
無回答
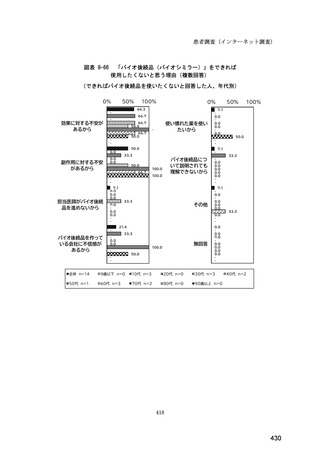
【その他(自由記載)の具体的な内容】
・一般的名称を入力すると院内採用のある製品は自動的にバイオ後続品になるため、経営の方針
で勤務している医師には基本的に決定権がない
など
282
294