提案書03(0399頁~0598頁)医療技術評価・再評価提案書 (144 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190899_00011.html |
| 出典情報 | 中央社会保険医療協議会 診療報酬調査専門組織・医療技術評価分科会(令和5年度第1回 11/20)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
提案番号(6桁)
申請技術名
申請学会名
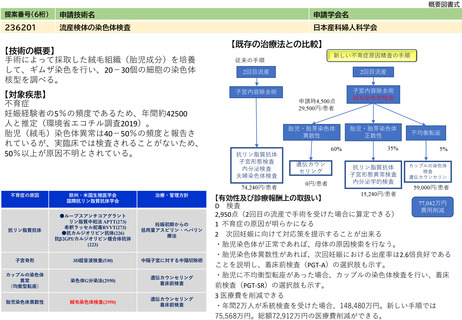
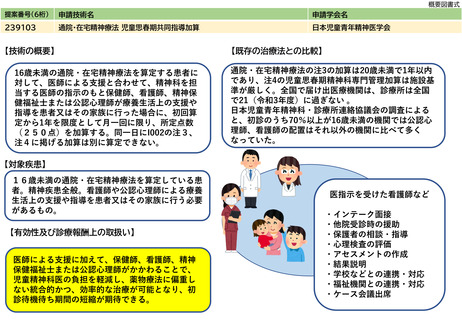
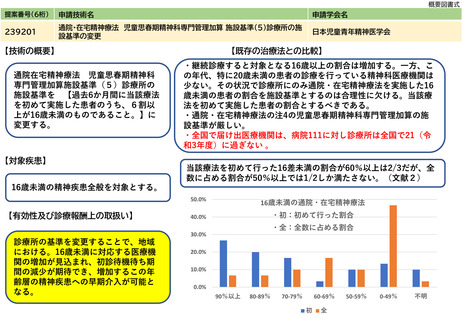
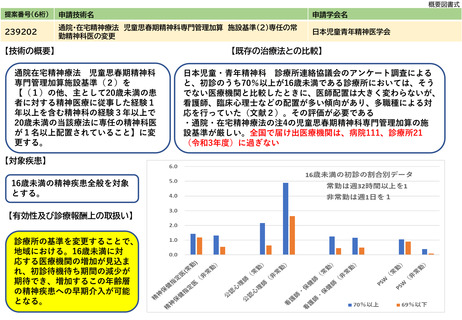
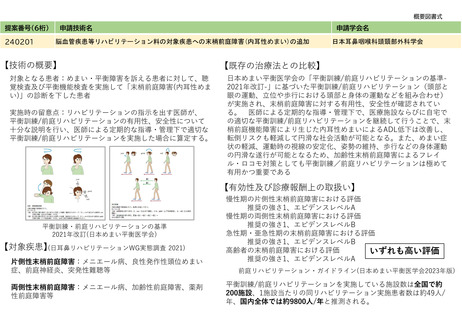
238202
体内デバイス安全管理加算
日本磁気共鳴医学会
近年、体内デバイス(ペースメーカ、人工内耳、脳深部刺激装置等)が多数出現し、MRI検査を
安全に行うにはデバイスごとに放射線部の内部と外部において複数の部署での連携が重要である。
これらを臨床現場で運用する際は、適切な管理や運用支援が必要である。
個々の体内デバイスは薬機法上の承認等を得ており、MRI撮像時の方法等について企業
からのマニュアル等を準拠すれば、臨床上は問題ない。一方で、これらの体内デバイスを有す
る患者をMRI検査をする場合、その運用マニュアルやデバイス担当医師やパラメディカルの役
割等は、製品ごとに異なる。多数の体内デバイスがあるため、デバイスごとに担当チームをお
いて適切に運用されるように管理する必要がある。
MRI検査の際の問題点例
MRI検査室での管理
人工内耳
デバイス固定の不良による磁石の
反転やMRI検査中の痛みによる
検査の中止
• MRI安全管理チーム(責任医師、放射
線技師、看護師)の設置
• チーム内での会合
• 施設内での講習
• MRI関連団体での講習会参加
• 安全性情報の報告体制の整備
不整脈デバイス
臨床MRI安全運用のための指針(2020)
脳深部刺激装置
複数の部署の連携が必要
検査中の不整脈発生や機器故障後
の対応の遅れ
不適正なMRI装置使用によるデバイス
の故障や神経学的合併症の発生
体内デバイス安全管理の項目を画像診断管理加算2,3の施設基準とし、
542
それぞれ190点 350点とする
体内デバイス管理指針
日本磁気共鳴医学会、医学
放射線学会ではガイドライン
等を作成し、放射線部の内
部と外部を連携した臨床上の
運用の管理等を実施すること
となった。
複数の部署での連携の運用を支援
• デバイスごとに管理チームの設置
• 多職種間の連携強化
• 教育活動の実施
• 患者への説明・同意
• 運用マニュアルの整備
• 安全性情報の報告体制の整備
• 責任医師の配置 等
MRI検査を安全に行なうための
体内デバイス管理指針(2021)