提案書07(1200頁~1401頁)医療技術評価・再評価提案書 (104 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190899_00011.html |
| 出典情報 | 中央社会保険医療協議会 診療報酬調査専門組織・医療技術評価分科会(令和5年度第1回 11/20)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
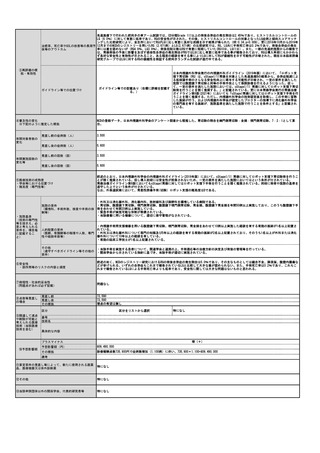
治癒率、死亡率やQOLの改善等の長期予 ソカブタゲン マラルユーセル)、濾胞性リンパ腫(リソカブタゲン マラルユーセル)、急性リンパ芽球性白血病(チサゲンレクリユーセル)、
多発性骨髄腫(イデカブタゲン ビクルユーセル、シルタカブタゲンオートルユーセル)に対して承認されており、それぞれの疾患において従来
後等のアウトカム
の治療と比べて良好な成績が報告されている。
③再評価の根
拠・有効性
ガイドライン等での位置づけ
④普及性の変化
※下記のように推定した根拠
年間対象者数の
変化
年間実施回数の
変化等
チサゲンレクルユーセル (販売名:キムリア🄬🄬点滴静注)
アキシカブタゲン シロルユーセル (販売名:イエスカルタ
リソカブタゲン マラルユーセル
(販売名:ブレヤンジ🄬🄬点
イデカブタゲン ビクルユーセル
(販売名:アベクマ🄬🄬点滴
見直しにより本治療を受ける症例数自体は変化しない。末梢血単核球採取に関しては、現状でも規格外製品の治験に該当しない製造不良例で、か
つ病状として再採取(アフェレーシス)が可能な症例に関しては再採取(アフェレーシス)が行われているが、現行の規定により診療報酬の償還
は行われていない。
見直し前の症例数(人)
保険収載されているキメラ抗原受容体発現T細胞輸注療法の4製剤あり、合計で約500人/年と推測される。
見直し後の症例数(人)
変化なし
見直し前の回数(回)
患者1人につき1回。
見直し後の回数(回)
制限せず(実際的には2回までになると想定される)
⑤医療技術の成熟度
・学会等における位置づけ
・難易度(専門性等)
・施設基準
(技術の専門性
等を踏まえ、必
要と考えられる
要件を、項目毎
に記載するこ
と)
最適使用推進ガイドライン
最適使用推進ガイドライン
🄬🄬点滴静注)
ガイドライン等での記載あり(右欄に詳細を記載す
最適使用推進ガイドライン
る。)
滴静注)
最適使用推進ガイドライン
静注)
キメラ抗原受容体発現T細胞輸注療法は、再発又は難治性の大細胞型リンパ腫(チサゲンレクルユーセル、アキシカブタゲン シロルユーセル、リ
ソカブタゲン マラルユーセル)、濾胞性リンパ腫(チサゲンレクリユーセル、リソカブタゲン マラルユーセル)、急性リンパ芽球性白血病(チ
サゲンレクリユーセル)、多発性骨髄腫(イデカブタゲン ビクルユーセル、シルタカブタゲンオートルユーセル)に対して承認されている。治
療施設において採取した末梢血単核球が製品の原材料となるため、末梢血単核球に関しても品質管理が重要となる。
施設の要件
(標榜科、手術件数、検査や手術の体 キメラ抗原受容体発現T細胞輸注療法については、各製剤ごとに最適使用推進ガイドラインにおいて施設要件が定められている。
制等)
最適使用推進ガイドラインにおいて、アフェレーシス機器の使用に熟知した医療スタッフ(医師、看護師又は臨床工学技士)が配置されており、
人的配置の要件
(医師、看護師等の職種や人数、専門 アフェレーシス中には少なくとも1 名の医療スタッフ(医師、看護師又は臨床工学技士)による常時監視体制及び医師への連絡体制が整っている
ことが要件とされている。
性や経験年数等)
その他
(遵守すべきガイドライン等その他の 特になし
要件)
⑥安全性
・副作用等のリスクの内容と頻度
白血球アフェレーシスにおいては、再発難治状態の対象疾患治療中の患者に対して長時間にわたる体外循環が行われるため、それに伴う血圧変
動、不整脈、低カルシウム血症、出血などの副作用が起こりうる。
⑦倫理性・社会的妥当性
(問題点があれば必ず記載)
イデカブタゲン ビクルユーセルの実臨床データの米国からの報告では、末梢血単核球採取を行ったにも関わらず製造不良となった症例の58%は
再アフェレーシスにより製剤の製造に成功した、としている。現行の保険収載の規定に基づいて「患者1人につき1回」しか単核球採取を施行しな
いとすると、患者から本治療の機会を逸失させることになり、倫理的問題が大きいと考えられる。
⑧点数等見直し
の場合
見直し前
見直し後
その根拠
―
―
―
区分
⑨関連して減点
や削除が可能と
考えられる医療
技術(当該医療
技術を含む)
なし
区分をリストから選択
番号
技術名
―
―
具体的な内容
―
増(+)
プラスマイナス
⑩予想影響額
予想影響額(円)
5,807,500円
その根拠
キメラ抗原受容体発現T細胞輸注療法のための末梢血単核球採取が年間500例において行われ、製造不良が7%において発生すると仮定すると35例
となる。うち20人が「採取のみを行う場合」、15人が「採取、細胞調製及び凍結保存を行う場合」と仮定して影響額を算出すると、
144,800円×20人 + 194,100円×15人 = 5,807,500円 となる。
備考
―
⑪算定要件の見直し等によって、新たに使用される医薬
品、医療機器又は体外診断薬
なし
⑫その他
なし
⑬当該申請団体以外の関係学会、代表的研究者等
一般社団法人
日本再生医療学会、一般社団法人再生医療イノベーションフォーラム(FIRM)
1303