提案書07(1200頁~1401頁)医療技術評価・再評価提案書 (79 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190899_00011.html |
| 出典情報 | 中央社会保険医療協議会 診療報酬調査専門組織・医療技術評価分科会(令和5年度第1回 11/20)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
・副作用等のリスクの内容と頻度
ファブリー病の治療のアガルシダーゼアルファの長期投与に係る報告では、調査例数 493症例で、副作用発現症例数は121症例(24.5%)である
が、頻度としては、発疹(26.0%)、倦怠感(20.9%)、四肢痛(12.8%)、下痢(9.9%)など、ごく軽度なものであった(Sasa H.et al.:Mol
Genet Metab,126(4):448-459,2019)。また、アガルシダーゼベータ海外第III相試験における副作用の発現率では、0~6ヵ月で66%、6~12ヵ月
で59%、12~18ヶ月では46%、18~24ヶ月で29%、24~30ヶ月で21%、30~36ヶ月では14%であり、経時的に減少傾向であった。アナフィラキシー
を起こした患者はいなかった。過去4か月以内(少なくとも8回のERT)にIARがなく、臨床的安定が認められ、最低4回は同じ注入速度で投与がで
きており、投与中の重篤なIARを認めない患者は在宅での酵素補充療法の対象になり得た。(William R et al, Am. J. Hum. Genet. 75:65–74,
2004)。
ゴーシェ病の治療である、イミグルセラーゼでは、1994~2004年長期安全性の国際レビューでは、承認後初期(1994年~1997年)の計59件の
IAR(吐き気、嘔吐、頭痛、そう痒症、蕁麻疹、発疹、胸痛/圧迫感、倦怠感/無力症、紅潮、呼吸困難など)のうち、44件が関連有りと報告さ
れたが、44例全てでイミグルセラーゼ治療が継続された。これらのIARの大半は投与速度低下や解熱薬/抗ヒスタミン薬等の前投薬で改善が得ら
れ、さらなる治療を必要としなかった。後期(1997年~2004年)の約4200名の患者に関しては、IARで投与が中止になった患者は4名のみで、その
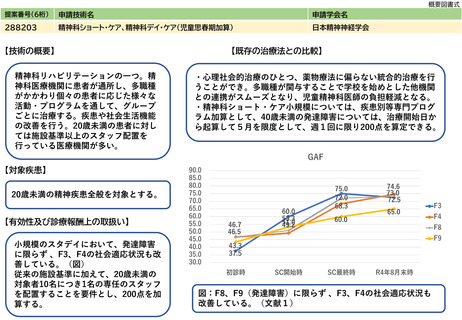
4名のうち3名は高齢者であり、治療中断がAE/忍容性に直接関係していたかどうかは不明であった(Kathryn Starzyk et al Molecular Genetics
and Metabolism Volume 90, Issue 2, February 2007, Pages 157-163)。
ムコ多糖症Ⅱ型(ハンター症候群)治療におけるイデュルスルファーゼ(エラプレース)の安全性と有効性で、日本における長期使用に関する
特定使用成績調査(PMS)では、観察期間8年、登録された172例中145例が安全性解析対象例となった。計40名の患者が途中で投与中止となってい
るが、うち副作用を理由とした離脱は5名であった。本調査における副作用発現率は48.3%(70/145例)、主な副作用は蕁麻疹、発熱、発疹、喘
鳴、紅斑であった(Kazuo Ueda et al Expert Opin Drug Saf. 2020 Jul;19(7):891-901. doi: 10.1080/14740338.2020.1751120. Epub 2020
Apr 28. )。
IARの予防およびIAR発症後の迅速な対応のためには、専門医による酵素補充療法の中でIAR等の副作用が抑えられてリスクが低下した状態で、
専門医ーかかりつけ医(在宅医)ー訪問看護師の連携の下、在宅酵素補充療法に移行することが重要である。
⑦倫理性・社会的妥当性
(問題点があれば必ず記載)
2021年1月に実施した患者会アンケート結果より、ライソゾーム病患者の在宅投与の必要性が示されている。海外においては、新型コロナウイル
ス感染症を機に在宅投与の推奨がされた事例もあり、在宅での酵素補充療法の推進は妥当であると考える。一方で、1回の投与で1~4時間投与を
要することを踏まえた人的配置や診療報酬上の評価の在り方については前述のとおり検討の余地があると考えられる。
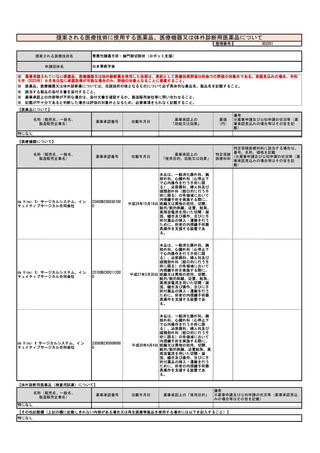
⑧点数等見直し
の場合
見直し前
見直し後
その根拠
1週につき100点
1週につき100点
「週3日以上」「3日目に算定」の要件の撤廃の要望のみで、点数そのものの見直しはない。
区分
⑨関連して減点
や削除が可能と
考えられる医療
技術(当該医療
技術を含む)
関連して減点や削除が可能と考えられる医療技術は無い。
その他(右欄に記載。)
番号
技術名
特になし
具体的な内容
特になし
増(+)
プラスマイナス
⑩予想影響額
予想影響額(円)
1,040,000円/年〜2,600,000円/年
その根拠
1週につき100点であり、酵素製剤の投与が1〜2週毎であることから、投与回数 = 算定回数であると考えられる。
1,000円×1,040回〜2,600回/年 = 1,040,000円/年〜2,600,000円/年
備考
投与回数は④の「年間実施回数の変化等」から引用した。
⑪算定要件の見直し等によって、新たに使用される医薬
品、医療機器又は体外診断薬
新たに採用されるものではないが、以下の酵素補充療法8疾患11製剤の在宅での使用は増加すると考えられる。
1.イミグルセラーゼ(遺伝子組換え)
2.ベラグルセラーゼ アルファ(遺伝子組換え)
3.アルグルコシダーゼ アルファ(遺伝子組換え)
4.アガルシダーゼ ベータ(遺伝子組換え)
5.アガルシダーゼ ベータ(遺伝子組換え)[アガルシダーゼ ベータ後続1]
6.アガルシダーゼ アルファ(遺伝子組換え)
7.ラロニダーゼ(遺伝子組換え)
8.イデュルスルファーゼ(遺伝子組換え)
9.エロスルファーゼ アルファ(遺伝子組換え)
10.ガルスルファーゼ(遺伝子組換え)
11.セベリパーゼ アルファ(遺伝子組換え)
⑫その他
ライソゾーム病に関する新しい酵素製剤が開発されており、「保険医が投与することができる注射薬」に追加して頂くように、日本先天代謝異常
学会として働きかけていく予定である。
⑬当該申請団体以外の関係学会、代表的研究者等
厚生労働科学研究補助金 難治性疾患政策研究事業「ライソゾーム病、ペルオキシソーム病(副腎白質ジストロフィーを含む)における
良質かつ適切な医療の実現に向けた体制の構築とその実装に関する研究」(研究代表者 奥山 虎之)
1278