【資料No.1】2.5_臨床に関する概括資料 (124 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
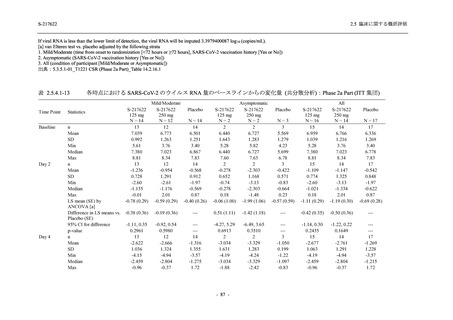
2.5 臨床に関する概括評価
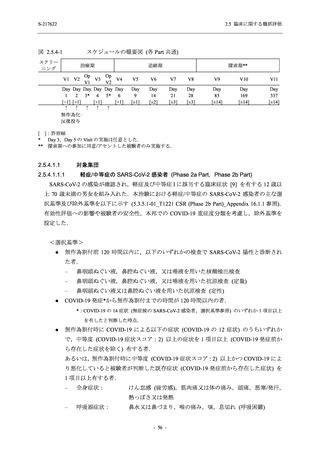
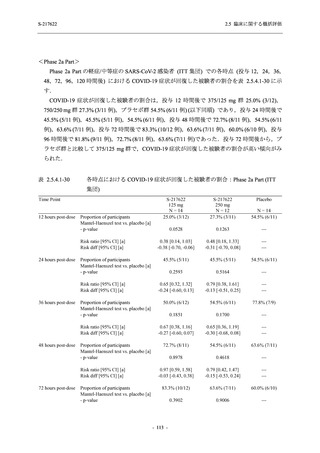
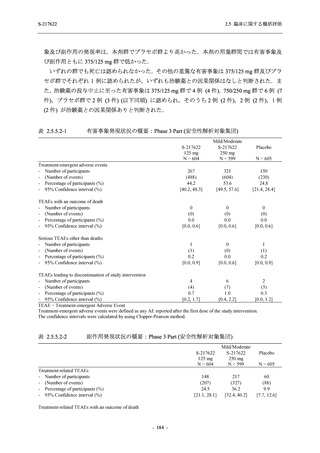
た 5 症状に関して,プラセボ群との間で有意な改善がみられた.これらの症状はオミクロン株
に特徴的な症状であり,オミクロン株による感染が主流であった時期に実施した Phase 2b Part
において,呼吸器症状に熱っぽさ又は発熱を加えた 5 症状でプラセボ群と比較して有意な改善
がみられたことは,本剤の臨床症状改善効果を反映した結果であると考えられる.
また,味覚症状は post-acute COVID-19 syndrome として回復後も遷延することが知られており
[14],味覚異常又は嗅覚異常のスコアのベースラインからの変化量について各時点でプラセボ
と比較して有意な減少が認められたこと,治験期間の後半においても,プラセボ群と比較して
本剤群で味覚異常又は嗅覚異常を有する被験者の割合が低かったことは,遷延する症状に対し
ても本剤の有効性が期待できる.
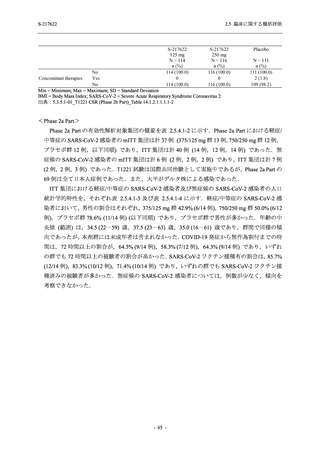
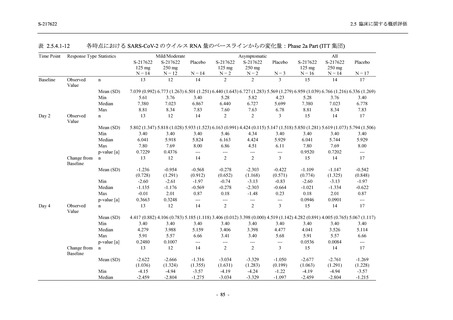
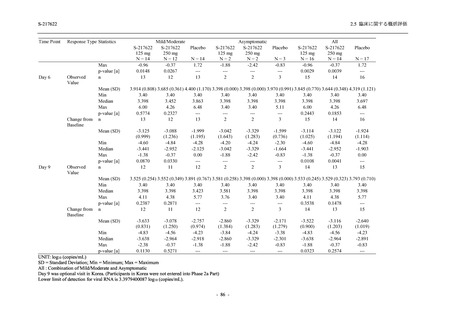
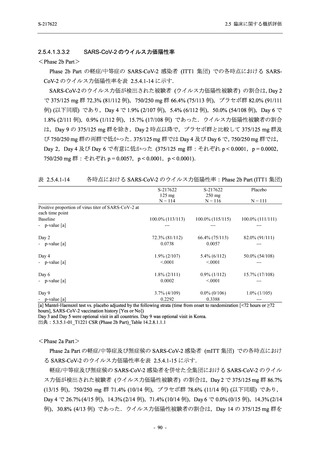
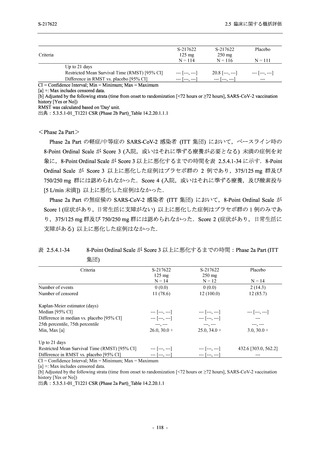
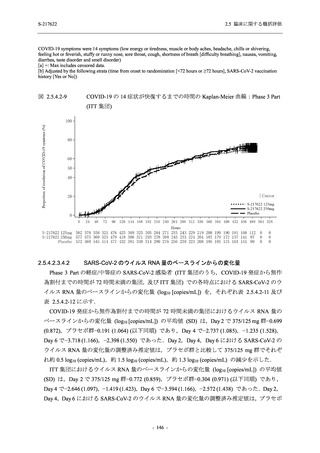
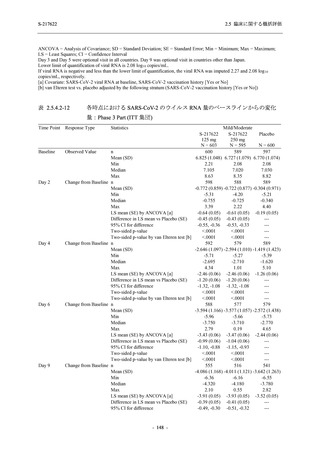
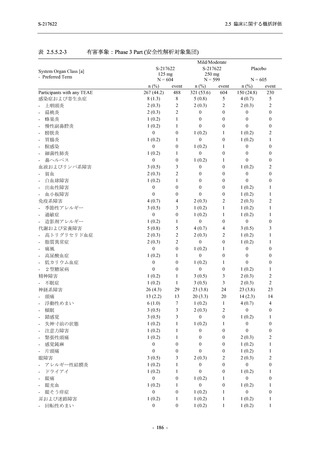
Phase 2a Part では,軽症/中等症及び無症候の SARS-CoV-2 感染者を併せた全集団において,
主要評価項目として設定したウイルス力価のベースラインからの変化量は,Day 4 時点でプラ
セボ群と比較して 375/125 mg 群及び 750/250 mg 群の両群で約 1 log10 (TCID50/mL) の減少を示
し,調整済み変化量の推定値もプラセボ群と比較して約 1 log10 (TCID50/mL) の減少を示した.
また,ウイルス RNA 量のベースラインからの変化量も,Day 4 時点でプラセボ群と比較して
375/125 mg 群及び 750/250 mg 群の両群で約 1.4 log10 (copies/mL) の減少を示し,調整済み変化
量の推定値もプラセボ群と比較して約 1 log10 (copies/mL) の減少を示したこと等から,本剤の抗
ウイルス効果が確認された.また,臨床症状についても,軽症/中等症の SARS-CoV-2 感染者に
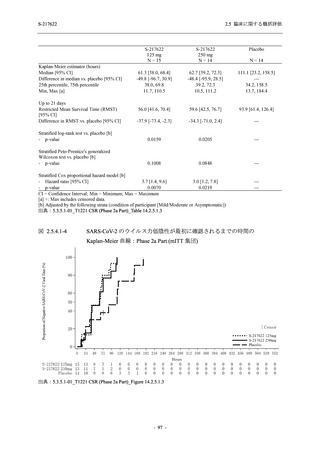
おける COVID-19 症状が回復するまでの時間は,中央値では群間で同程度であったものの,罹
患期間の別の要約指標である 21 日までを境界とする RMST はプラセボ群と比較して 375/125 mg
群で短縮される傾向がみられたこと,COVID-19 の 12 症状合計スコアは,投与 12 時間後から
プラセボ群より 375/125 mg 群及び 750/250 mg 群の両群で減少がみられたこと,COVID-19 症状
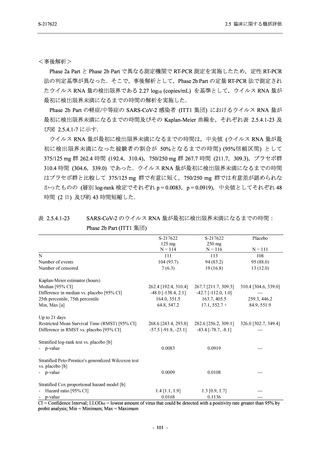
が回復した被験者の割合についても,投与 72 時間後から,プラセボ群と比較して 375/125 mg 群
で高い傾向がみられたこと等から,臨床症状改善効果も期待できる.
以上より,本剤の 1 日 1 回 5 日間の経口投与 (1 日目は 375 mg,2 日目から 5 日目は 125 mg)
により,軽症/中等症の SARS‑CoV‑2 感染者における抗ウイルス効果及び臨床症状改善効果が確
認された.
2.5.4.2
T1221 試験 Phase 3 Part に基づく評価
軽症/中等症の SARS-CoV-2 感染者に対する本剤の有効性を,T1221 試験 Phase 3 Part の主要な
結果を用いて追加評価した.
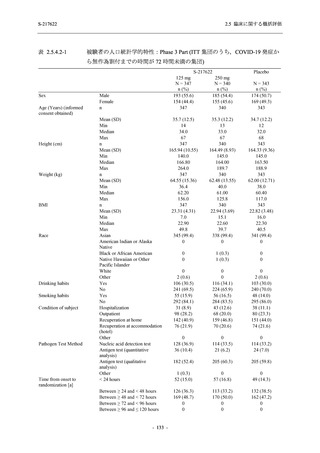
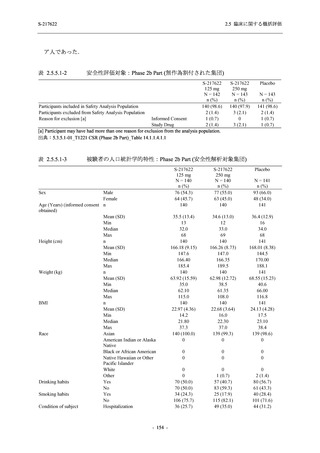
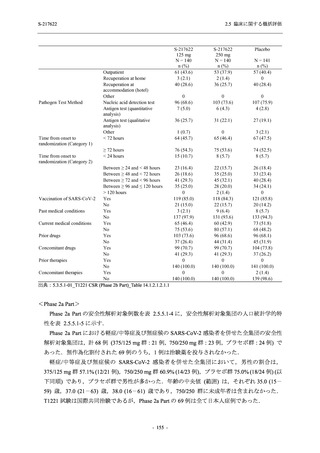
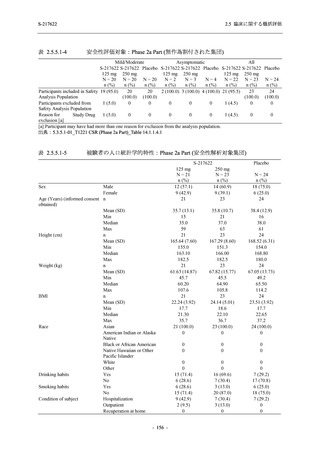
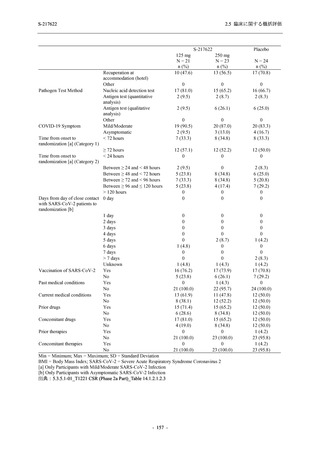
Phase 3 Part では軽症/中等症の SARS-CoV-2 感染者を,375/125 mg 群,750/250 mg 群,プラセ
ボ群の 3 群に 1:1:1 の比率で無作為に割付けた.各投与群の用法用量を以下に示す.各被験
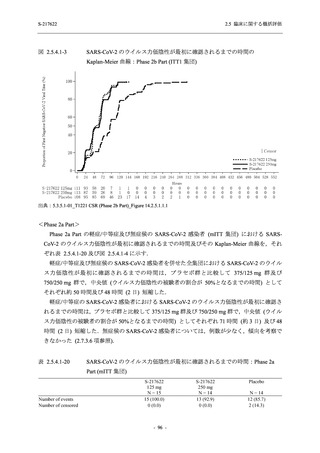
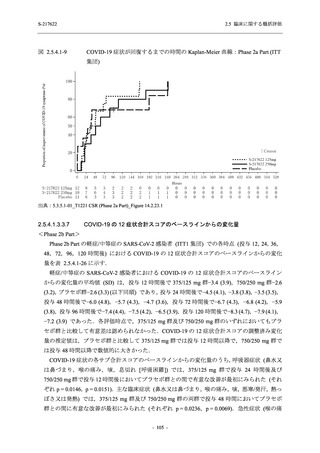
者の治験期間は 28 日間とし,21 日間の有効性及び 28 日間の安全性を評価した (図 2.5.4-1 参
照).
●
375/125 mg 群 (表中では「125 mg」と示す):
1 日 1 回 5 日間,以下の用量を経口投与した.
1 日目に 125 mg 錠 × 3 錠及び Placebo-D × 3 錠,2 日目から 5 日目に 125 mg 錠 × 1 錠及
- 124 -