【資料No.1】2.5_臨床に関する概括資料 (192 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.5 臨床に関する概括評価
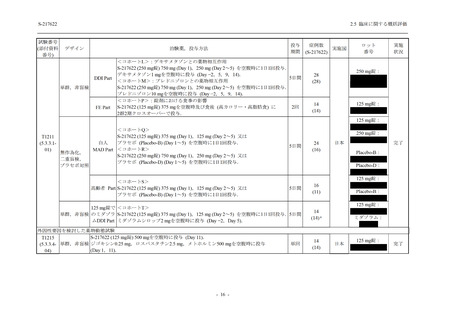
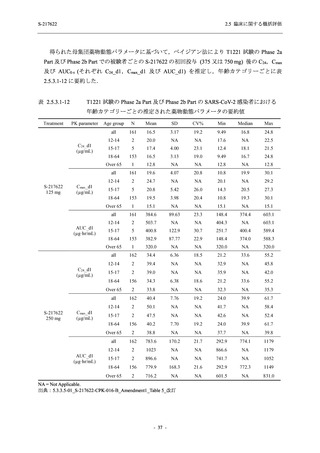
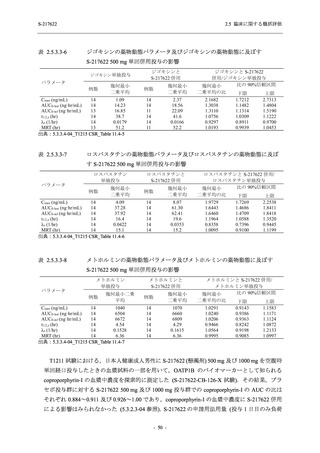
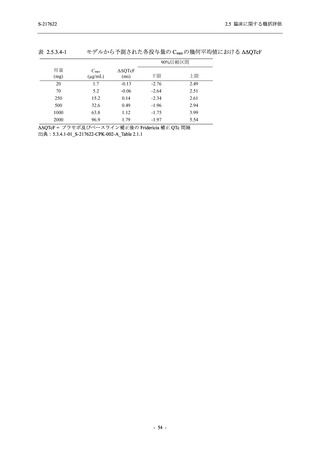
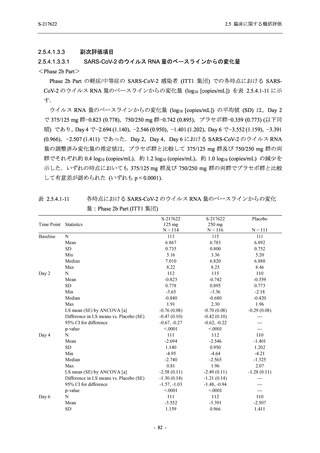
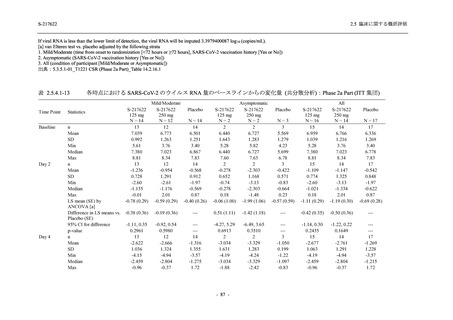
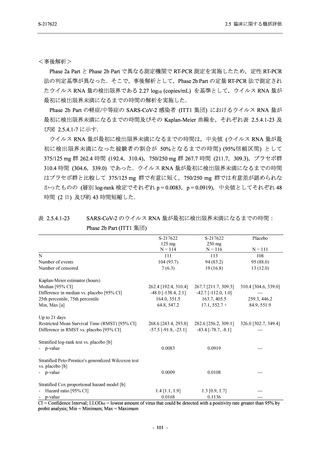
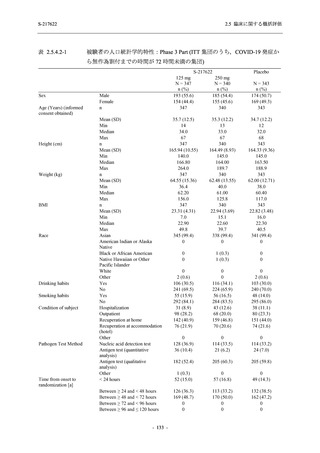
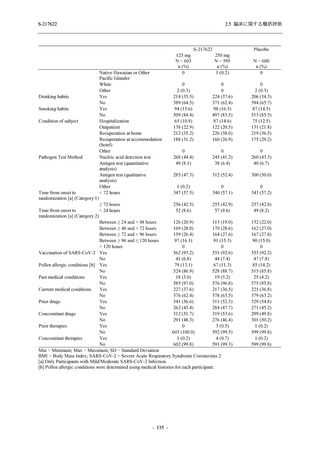
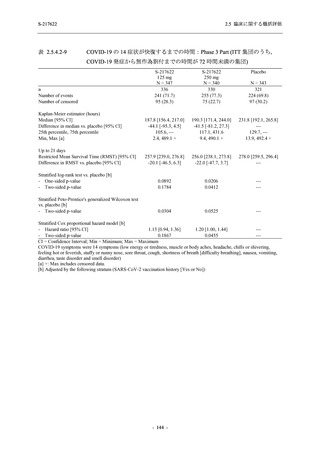
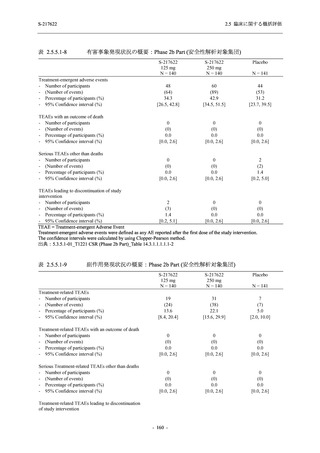
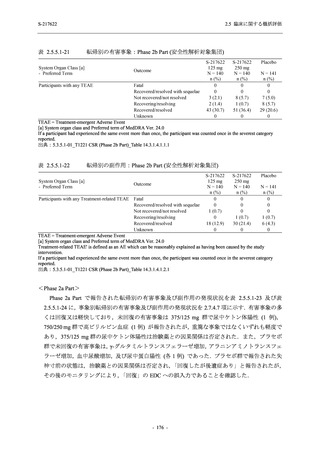
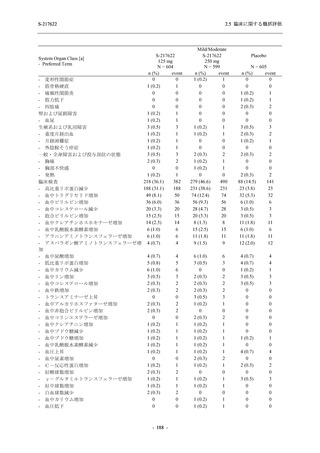
表 2.5.5.2-6
重症度別の副作用:Phase 3 Part (安全性解析対象集団)
System Organ Class [a]
- Preferred Term
Severity
Participants with any Treatment-related TEAE
Severe
Moderate
Mild
S-217622
125 mg
N = 604
n (%)
0
4 (0.7)
144 (23.8)
Mild/Moderate
S-217622
250 mg
N = 599
n (%)
1 (0.2)
11 (1.8)
205 (34.2)
Placebo
N = 605
n (%)
0
5 (0.8)
55 (9.1)
TEAE = Treatment-emergent Adverse Event
[a] System organ class and Preferred term of MedDRA Ver. 24.0
"Treatment-related TEAE" is defined as an AE which can be reasonably explained as having been caused by the study
intervention.
If a participant had experienced the same event more than once, the participant was counted once in the severest category
reported.
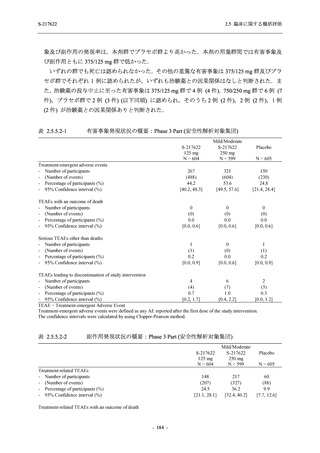
2.5.5.2.2.1.3
転帰別
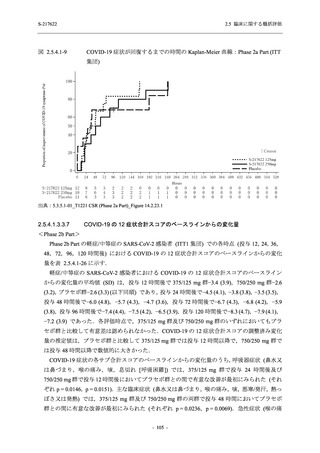
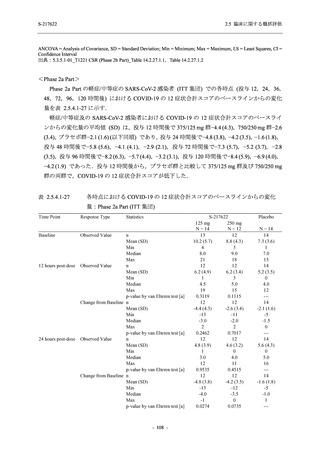
Phase 3 Part で報告された転帰別の有害事象及び副作用の発現状況を表 2.5.5.2-7 及び表
2.5.5.2-8 に,事象別転帰別の有害事象及び副作用の発現状況を 2.7.4.7 項に示す.有害事象の多
くは回復又は軽快した.未回復の事象のうち,治験薬との因果関係ありと判断された有害事象
は,750/250 mg 群で認められた発疹を除き,臨床検査関連の有害事象であり,重症度は軽度又
は中等度でかつ非重篤な事象であった.発疹の重症度は軽度であり非重篤な事象であった.
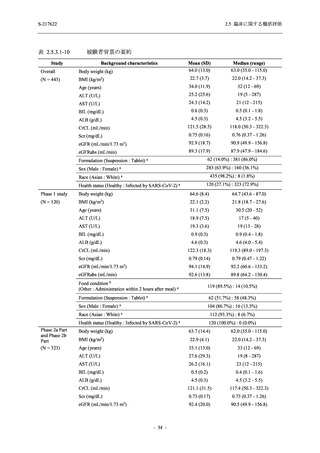
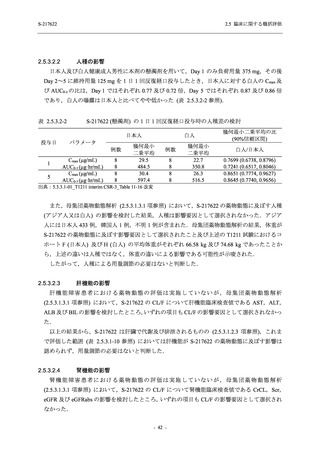
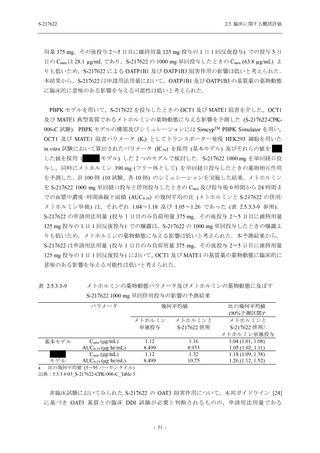
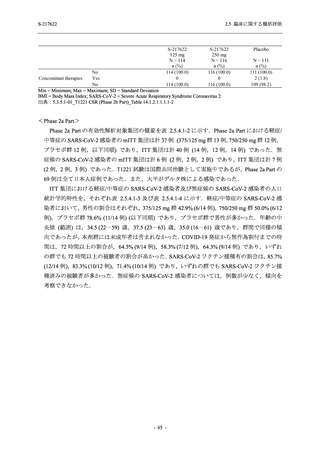
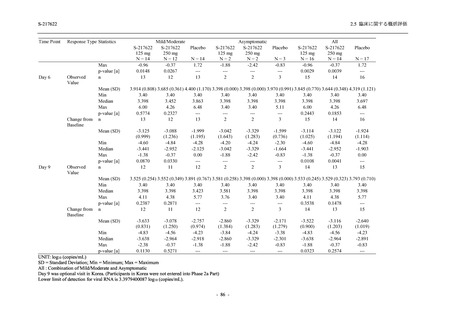
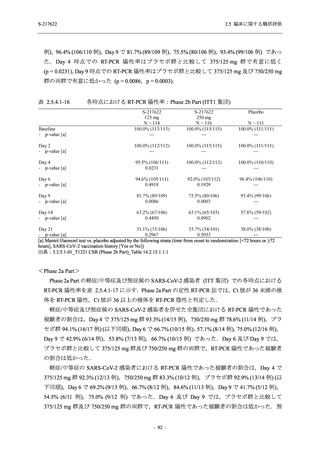
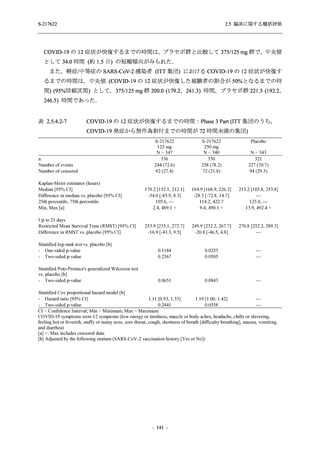
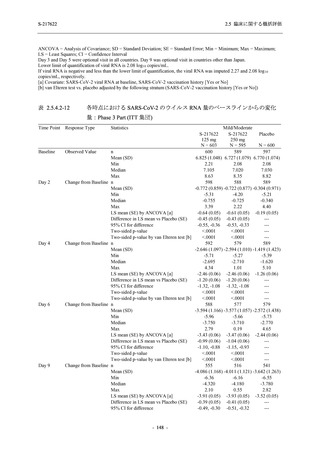
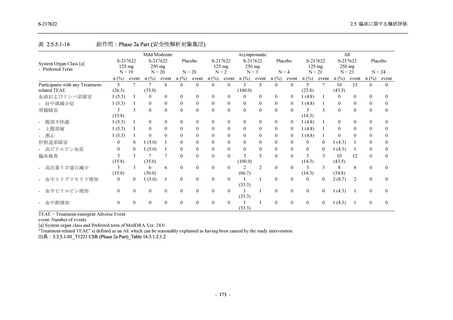
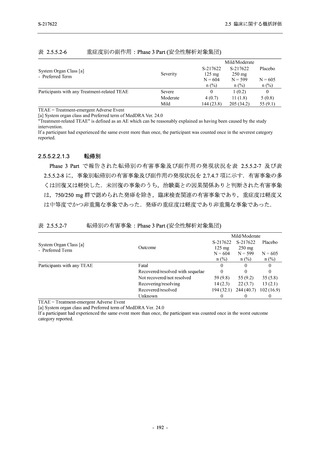
表 2.5.5.2-7
転帰別の有害事象:Phase 3 Part (安全性解析対象集団)
System Organ Class [a]
- Preferred Term
Participants with any TEAE
Outcome
Fatal
Recovered/resolved with sequelae
Not recovered/not resolved
Recovering/resolving
Recovered/resolved
Unknown
Mild/Moderate
S-217622 S-217622 Placebo
125 mg
250 mg
N = 604
N = 599
N = 605
n (%)
n (%)
n (%)
0
0
0
0
0
0
59 (9.8)
55 (9.2)
35 (5.8)
14 (2.3)
22 (3.7)
13 (2.1)
194 (32.1) 244 (40.7) 102 (16.9)
0
0
0
TEAE = Treatment-emergent Adverse Event
[a] System organ class and Preferred term of MedDRA Ver. 24.0
If a participant had experienced the same event more than once, the participant was counted once in the worst outcome
category reported.
- 192 -