【資料No.1】2.5_臨床に関する概括資料 (125 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.5 臨床に関する概括評価
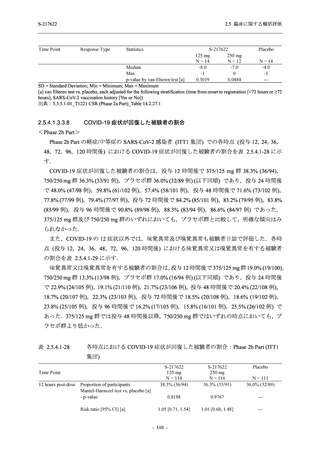
び Placebo-D × 1 錠を投与.
●
750/250 mg 群 (表中では「250 mg」と示す):
1 日 1 回 5 日間,以下の用量を経口投与した.
1 日目に 250 mg 錠 × 3 錠及び Placebo-B × 3 錠,2 日目から 5 日目に 250 mg 錠 × 1 錠及
び Placebo-B × 1 錠を投与.
●
プラセボ群:
1 日 1 回 5 日間,以下の用量を経口投与した.
1 日目に Placebo-B × 3 錠及び Placebo-D × 3 錠,2 日目から 5 日目に Placebo-B × 1 錠及
び Placebo-D × 1 錠を投与.
2.5.4.2.1
対象集団
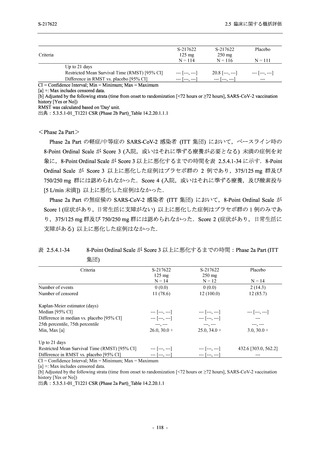
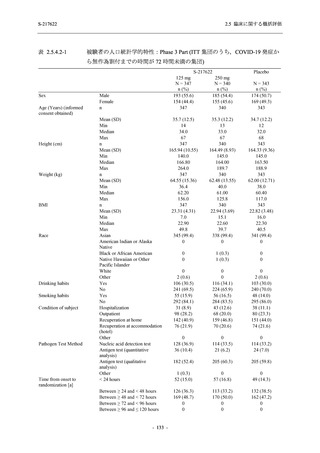
Phase 3 Part では,Phase 2a Part 及び Phase 2b Part と同様の選択基準及び除外基準を設定した
(2.5.4.1.1.1 項参照).
2.5.4.2.2
有効性評価項目及び統計手法
2.5.4.2.2.1
解析対象集団
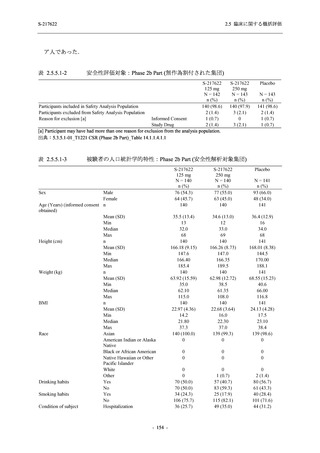
有効性の解析対象集団のうち,Phase 3 Part の intention-to-treat (ITT) 集団は,治験薬に無作為
に割付けられ,
かつ SARS-CoV-2 の感染が確認された被験者からなる集団と定義し,SARS-CoV-2
の感染は鼻咽頭ぬぐい液検体に基づく RT-PCR の結果で判定された.modified intention-to-treat
(mITT) 集団は,治験薬に無作為に割付けられ,SARS-CoV-2 の感染が確認され,かつベースラ
インでのウイルス力価が検出された被験者からなる集団と定義し,ウイルス力価の検出は,鼻
咽頭ぬぐい液検体に基づくウイルス力価測定で判定された.ITT 集団及び mITT 集団に対する
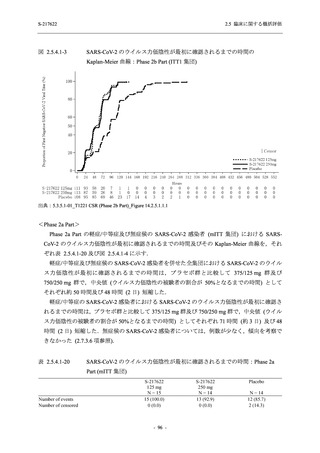
解析は,割付群に基づいて実施された.ITT 集団又は mITT 集団のうち,COVID-19 発症から無
作為割付までの時間が 72 時間未満の集団を主たる解析対象集団としたが,ITT 集団又は mITT
集団での評価も実施した.
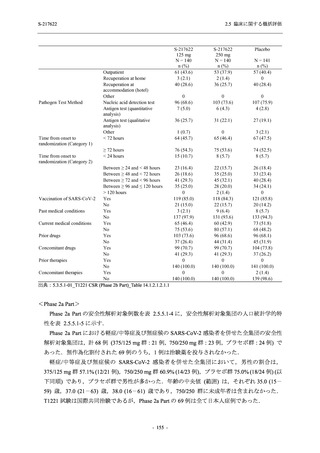
2.5.4.2.2.2
有効性評価項目
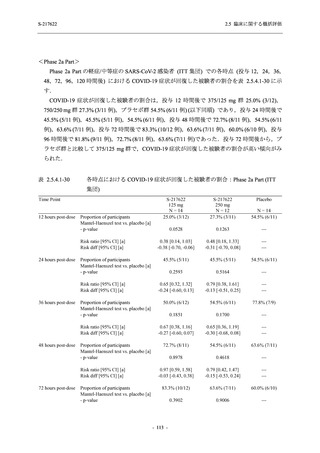
Phase 3 Part で設定した有効性評価項目のうち,以下の項目を基に本剤の有効性を評価した.
<主要評価項目>
●
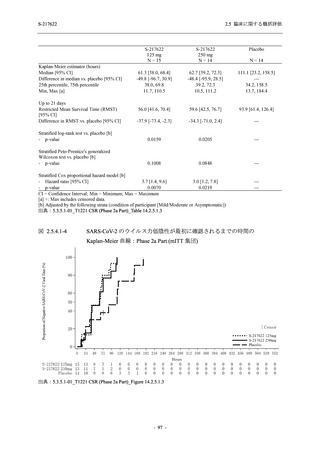
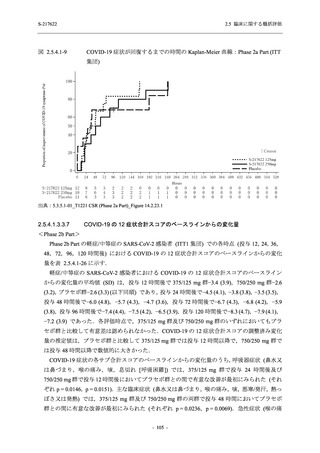
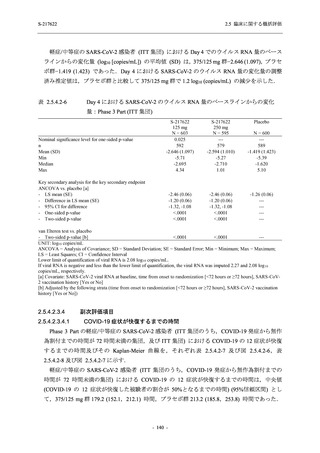
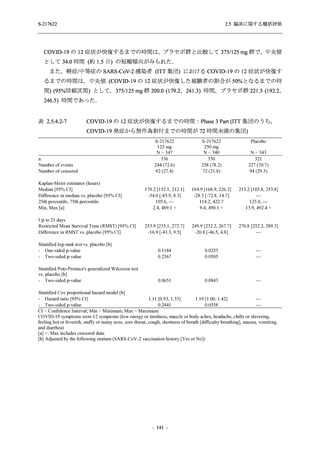
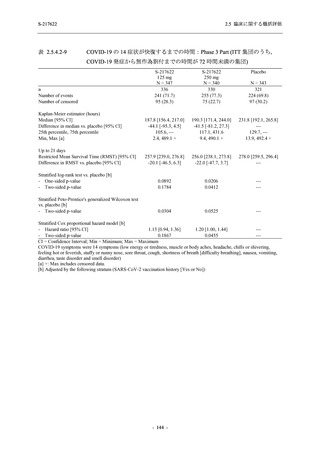
COVID-19 の 5 症状が快復するまでの時間
<主要な副次評価項目>
●
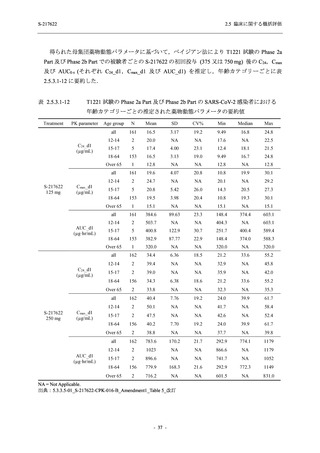
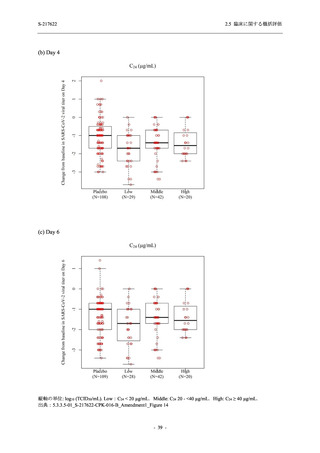
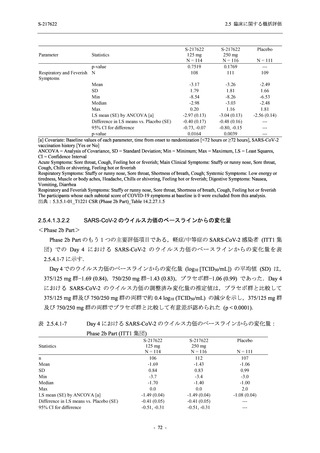
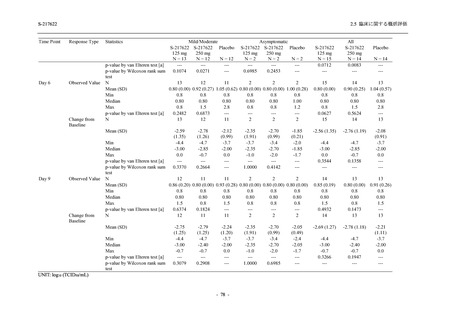
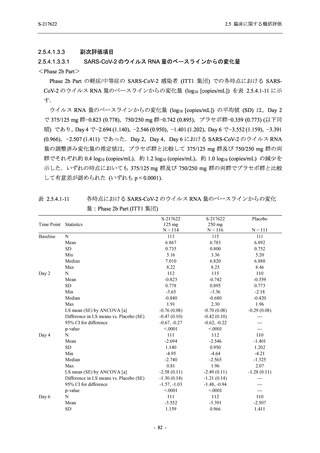
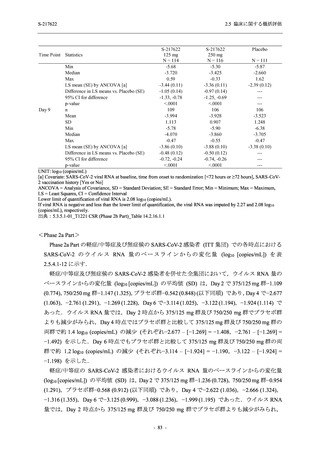
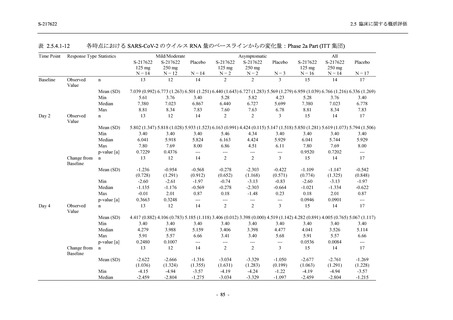
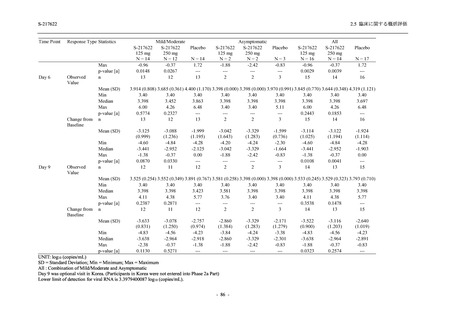
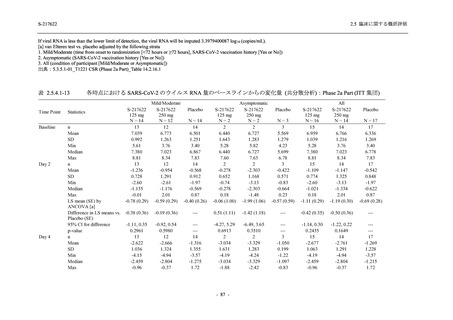
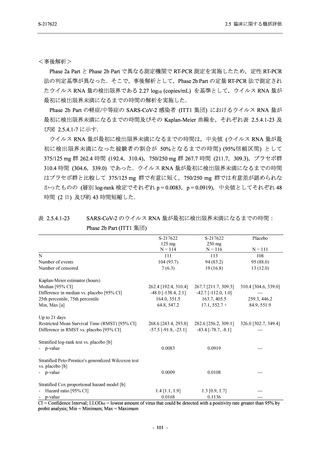
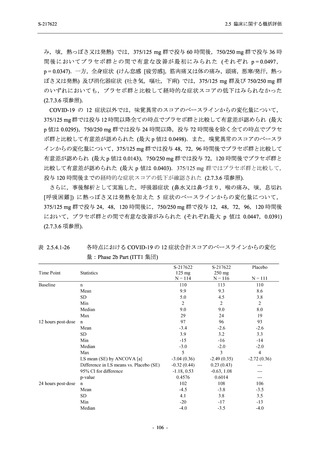
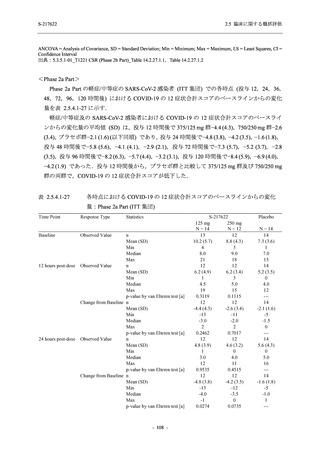
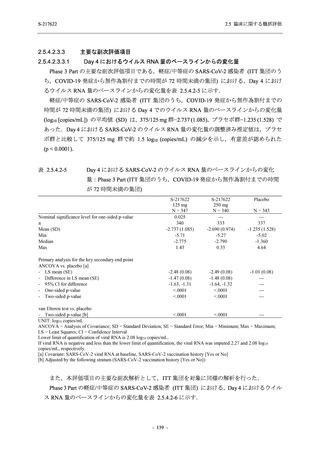
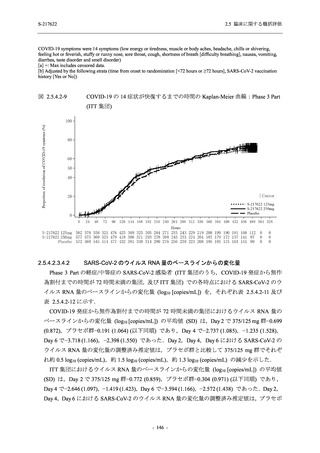
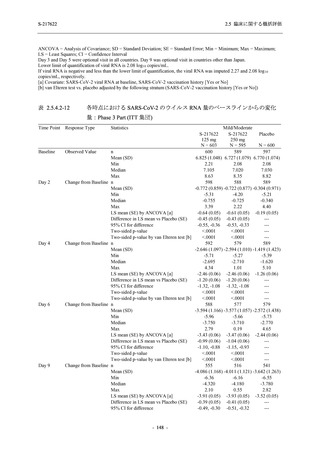
Day 4 におけるウイルス RNA 量のベースラインからの変化量
●
ウイルス力価陰性が最初に確認されるまでの時間 (未入手)
<その他の副次評価項目>
●
COVID-19 の 12 症状が快復するまでの時間
●
COVID-19 の 14 症状が快復するまでの時間
●
各時点におけるウイルス RNA 量のベースラインからの変化量
- 125 -