【資料No.1】2.5_臨床に関する概括資料 (166 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.5 臨床に関する概括評価
[40/140 例]),血中トリグリセリド増加 (6.4% [9/140 例]),頭痛,下痢,背部痛,及び脂質異常症
(それぞれ 2.1% [3/140 例]),プラセボ群では高比重リポ蛋白減少 (3.5% [5/141 例]),血中クレア
チンホスホキナーゼ増加及び上腹部痛 (それぞれ 2.8% [4/141 例]),発疹 (2.1% [3/141 例]) で
あった.開鍵以降,いずれかの群で 2%以上に報告された有害事象として新たに追加された事象
は,375/125 mg 群で頭痛,750/250 mg 群で血中トリグリセリド増加及び脂質異常症,プラセボ
群で血中クレアチンホスホキナーゼ増加及び上腹部痛であった.
また,2%以上に報告された副作用は,375/125 mg 群では高比重リポ蛋白減少 (9.3% [13/140
例]) のみ,750/250 mg 群では高比重リポ蛋白減少 (15.7% [22/140 例]) 及び脂質異常症 (2.1%
[3/140 例]) であった.プラセボ群で 2%以上に報告された副作用はなかった.開鍵以降,いずれ
かの群で 2%以上に報告された副作用として新たに追加された事象は,750/250 mg 群の脂質異
常症のみであり,375/125 mg 群及びプラセボ群ではなかった.
なお,Day 14 までの結果は,2.7.4.7 項に示す.
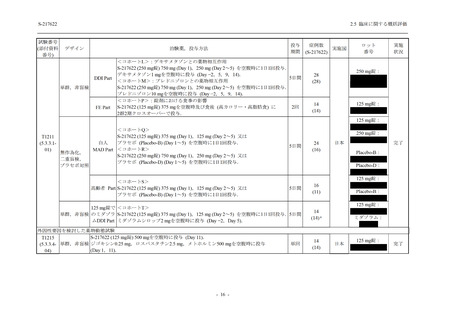
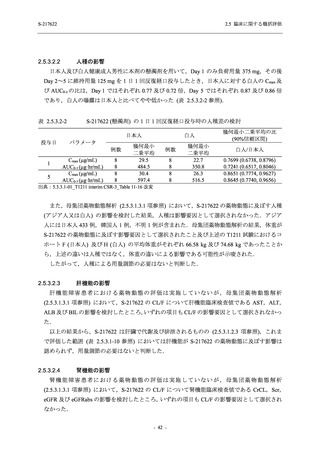
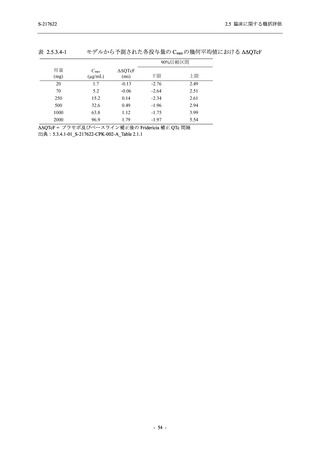
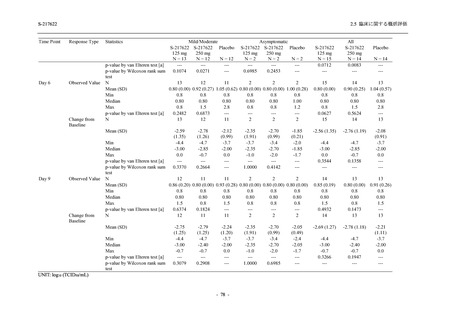
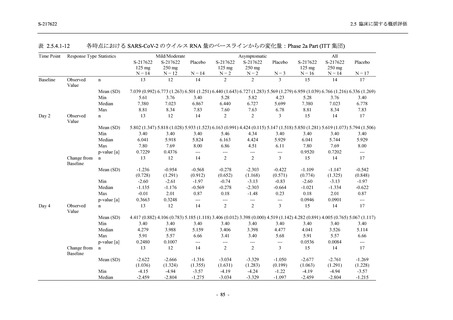
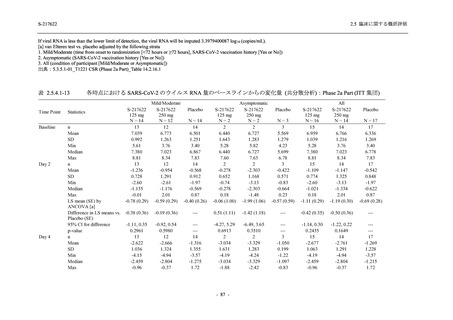
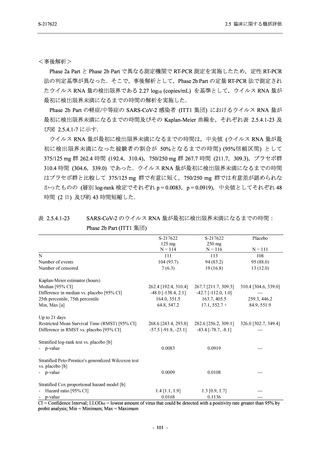
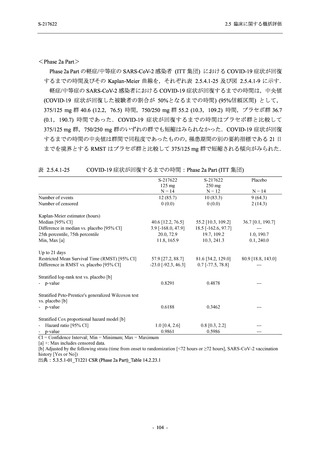
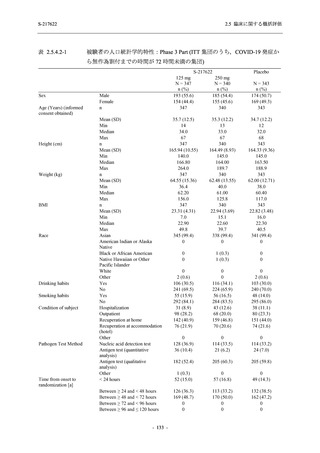
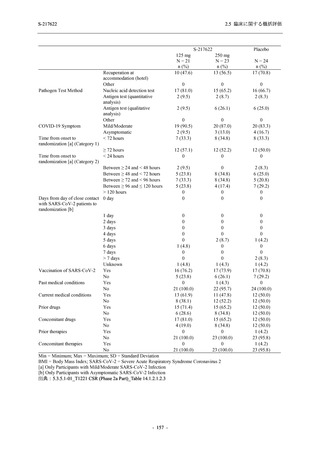
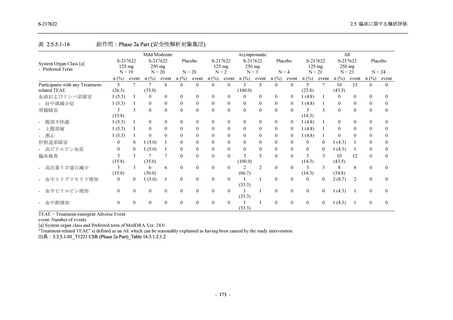
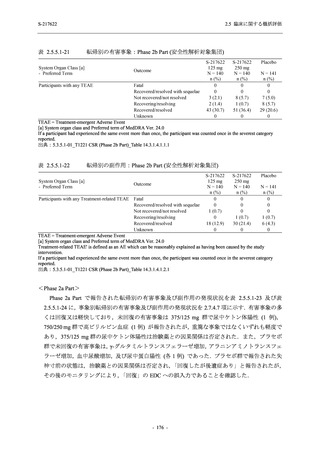
表 2.5.5.1-13
有害事象:Phase 2b Part (安全性解析対象集団)
System Organ Class [a]
- Preferred Term
Participants with any TEAE
感染症および寄生虫症
- 口腔ヘルペス
- 膀胱炎
- 上咽頭炎
- 副鼻腔炎
- レンサ球菌感染
- 帯状疱疹
- 麦粒腫
免疫系障害
- 季節性アレルギー
代謝および栄養障害
- 脂質異常症
- 高トリグリセリド血症
- 高尿酸血症
精神障害
- 不眠症
神経系障害
- 頭痛
- 感覚鈍麻
- 浮動性めまい
- 顔面麻痺
- 坐骨神経痛
- 傾眠
眼障害
- 結膜出血
- アレルギー性結膜炎
- 眼痛
心臓障害
S-217622
125 mg
N = 140
n (%)
event
48 (34.3)
64
2 (1.4)
2
0
0
1 (0.7)
1
0
0
1 (0.7)
1
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
1 (0.7)
1
1 (0.7)
1
3 (2.1)
3
3 (2.1)
3
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
1 (0.7)
1
- 166 -
S-217622
250 mg
N = 140
n (%)
event
60 (42.9)
89
4 (2.9)
4
2 (1.4)
2
0
0
1 (0.7)
1
0
0
1 (0.7)
1
0
0
0
0
2 (1.4)
2
2 (1.4)
2
3 (2.1)
3
3 (2.1)
3
0
0
0
0
1 (0.7)
1
1 (0.7)
1
4 (2.9)
4
3 (2.1)
3
1 (0.7)
1
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
Placebo
N = 141
n (%)
event
44 (31.2)
53
4 (2.8)
4
0
0
0
0
1 (0.7)
1
1 (0.7)
1
0
0
1 (0.7)
1
1 (0.7)
1
0
0
0
0
3 (2.1)
3
0
0
1 (0.7)
1
2 (1.4)
2
0
0
0
0
6 (4.3)
6
0
0
2 (1.4)
2
1 (0.7)
1
1 (0.7)
1
1 (0.7)
1
1 (0.7)
1
3 (2.1)
3
1 (0.7)
1
1 (0.7)
1
1 (0.7)
1
1 (0.7)
1