【資料No.1】2.5_臨床に関する概括資料 (182 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.5 臨床に関する概括評価
照).
以上より,妊婦又は妊娠している可能性のある女性には投与すべきでないと考える.また,
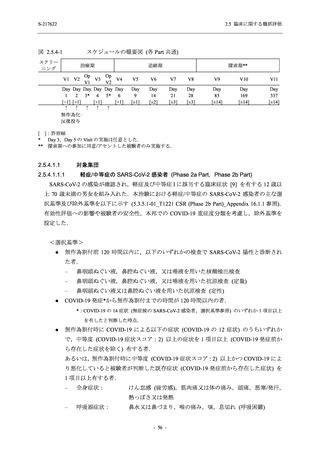
S-217622 (錠剤) の薬物動態評価対象集団で個々の被験者における半減期の最大値が 66.4 時間
(5.3.3.1-01_S-217622-CPK-007-A 参照) であることを踏まえると,妊娠の可能性のある女性は投
与期間中及び投与終了後 2 週間 (66.4 時間の 5 倍に相当) 適切な避妊を行うこと,また,授乳中
の女性には授乳しないことが望ましいと考えられた.そのため,これらについて添付文書にて
注意喚起することとした.
2.5.5.1.6.2
過量投与
T1221 試験において,軽症/中等症及び無症候の SARS-CoV-2 感染者に申請用量 (375/125 mg)
の 2 倍である 750/250 mg での投与実績があり,当該用量で安全性及び忍容性が確認されている
(2.5.5.1.2 項参照).
単回投与では健康成人に対して最大 2000 mg,反復投与では健康成人並びに軽症/中等症及び
無症候の SARS-CoV-2 感染者に対して 750/250 mg の投与経験があるものの,過量投与に関する
十分な情報が得られていないため,添付文書で注意喚起すべき中毒症状に関する情報はないと
判断した.
2.5.5.1.6.3
依存性・反跳現象・乱用
S-217622 の依存性・反跳現象・乱用を示唆する情報は得られていない.
2.5.5.1.6.4
自動車運転及び機械操作に対する影響又は精神機能の障害
非臨床薬物動態試験の結果から,本剤は中枢移行性が低く (2.4.3 項参照),自動車運転及び機
械操作に対する影響又は精神機能の障害を及ぼさないと考えられる.非臨床試験及び臨床試験
において,これらの影響を示唆する情報は得られていない.
2.5.5.1.7
安全性評価のまとめ
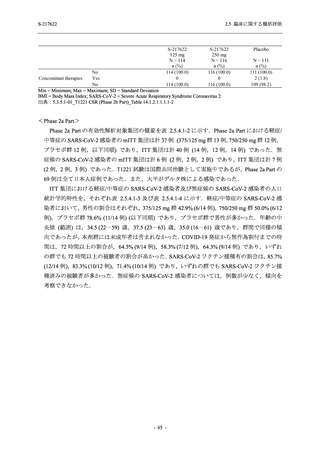
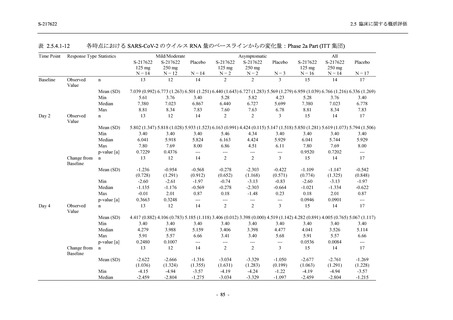
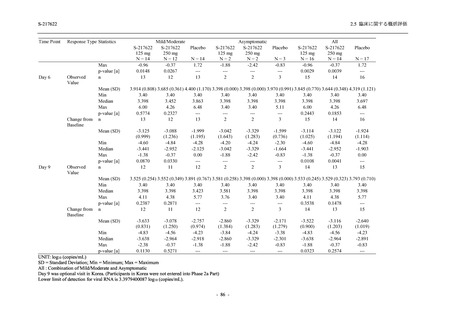
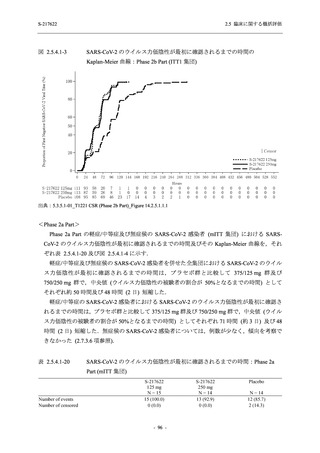
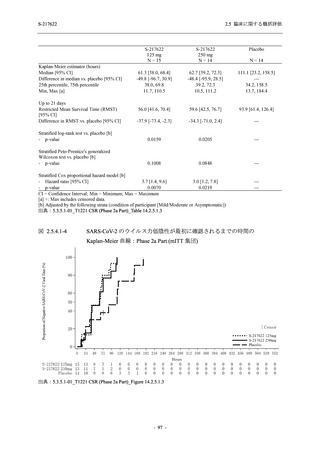
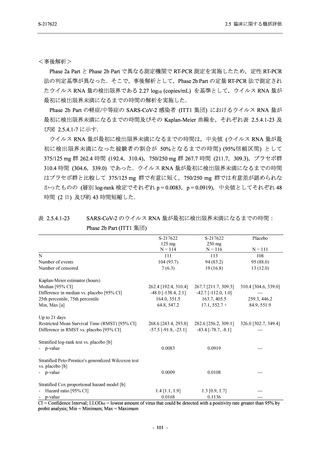
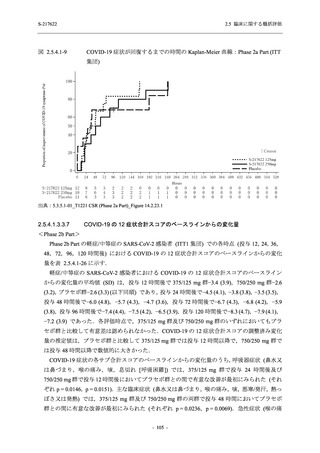
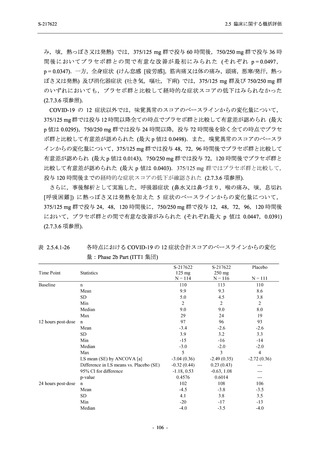
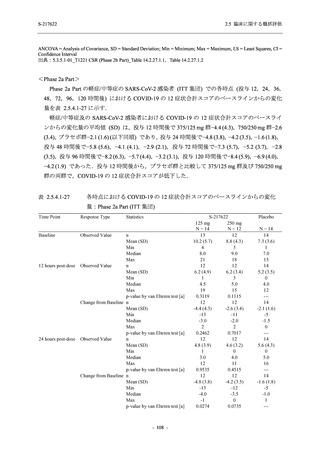
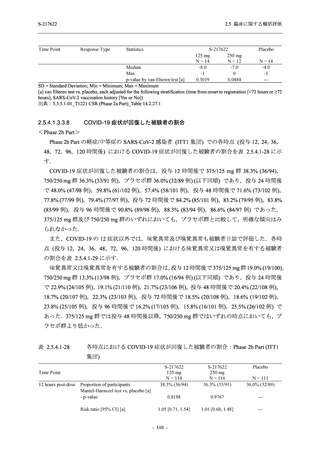
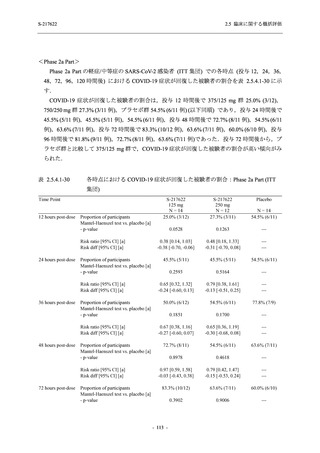
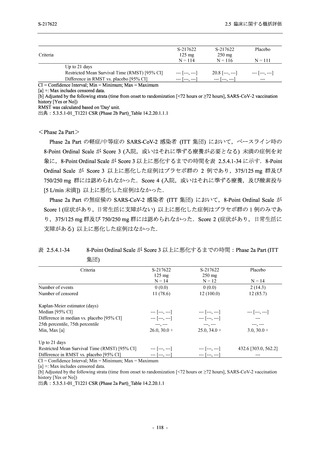
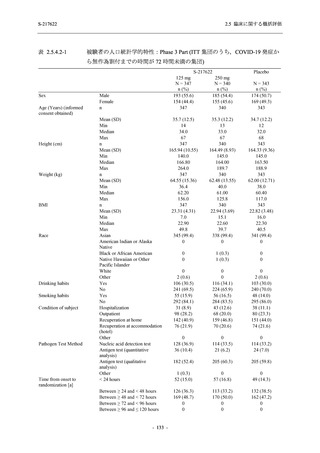
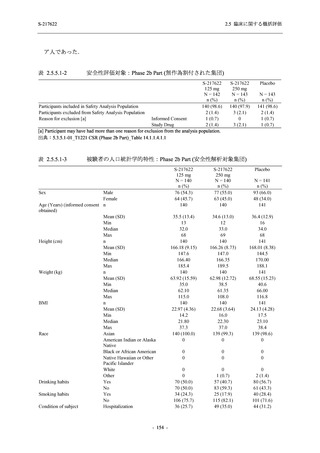
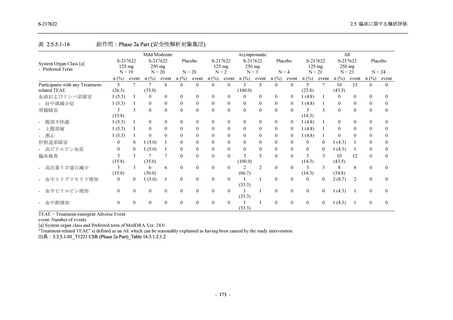
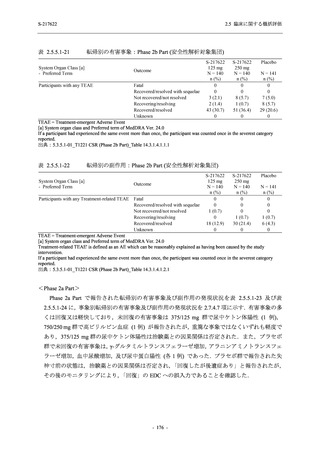
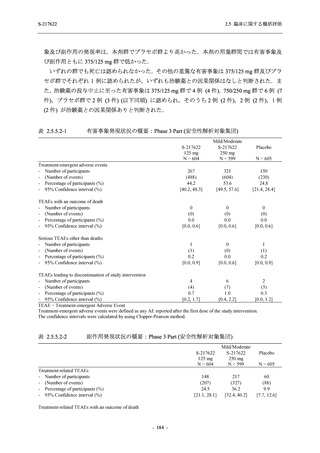
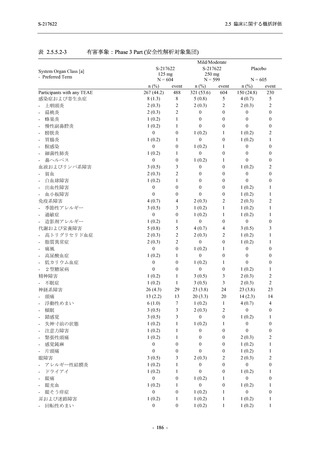
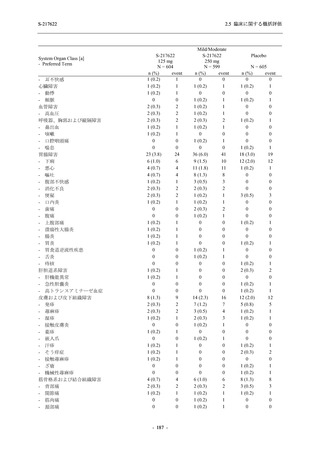
T1221 試験 Phase 2b Part の開鍵までにおいて,本剤群で死亡を含む重篤な有害事象は報告さ
れていない.有害事象の発現率は,375/125 mg 群 26.4% (37/140 例),750/250 mg 群 34.3% (48/140
例),プラセボ群 24.1% (34/141 例) (以下同順),副作用の発現率は 9.3% (13/140 例),18.6% (26/140
例),5.0% (7/141 例) であった.有害事象の発現率は,375/125 mg 群ではプラセボ群と同程度で,
750/250 mg 群ではプラセボ群より高く,副作用の発現率は両群ともプラセボ群より高かった.
本剤の用量群間では有害事象及び副作用ともに 375/125 mg 群で低かった.いずれかの群で 2%
以上に報告された有害事象は,375/125 mg 群では高比重リポ蛋白減少 (16.4% [23/140 例]) のみ,
750/250 mg 群では高比重リポ蛋白減少 (20.0% [28/140 例]),頭痛,下痢,背部痛,及び高トリグ
リセリド血症 (それぞれ 2.1% [3/140 例]),プラセボ群では発疹及び高比重リポ蛋白減少 (2.1%
[3/141 例]) であった.また,いずれかの群で 2%以上に報告された副作用は,375/125 mg 群及び
750/250 mg 群ともに高比重リポ蛋白減少 (5.7% [8/140 例] 及び 12.1% [17/140 例]) のみであっ
た.治験薬の投与中止に至った有害事象は,375/125 mg 群で 2 例に認められ,いずれも治験薬
- 182 -