【資料No.1】2.5_臨床に関する概括資料 (199 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
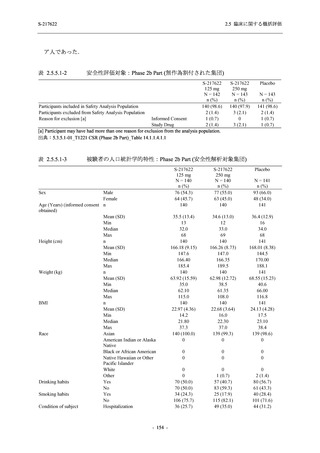
2.5 臨床に関する概括評価
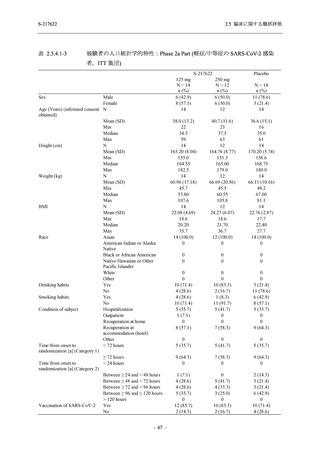
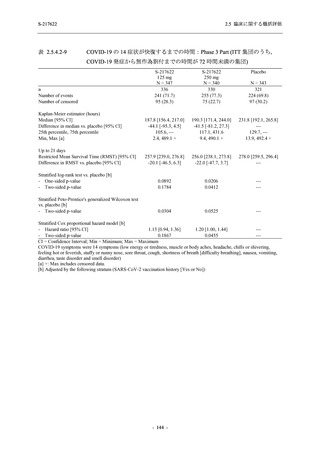
Part で一貫して,ウイルス力価及びウイルス RNA 量を基準とした,本剤の優れた抗ウイルス効
果を示唆する結果が得られている.ウイルス力価は感染性を有するウイルス量であるため,ウ
イルス力価による評価はウイルス RNA 量による評価よりも感度が高いことから,Phase 3 Part
においても,ウイルス力価を基準とした抗ウイルス効果が確認される可能性は高いと考える.
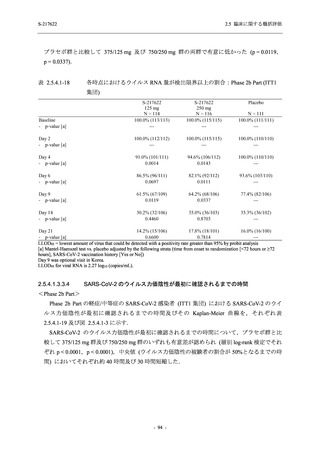
2.5.6.2.2
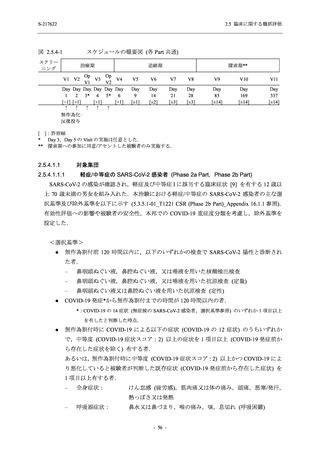
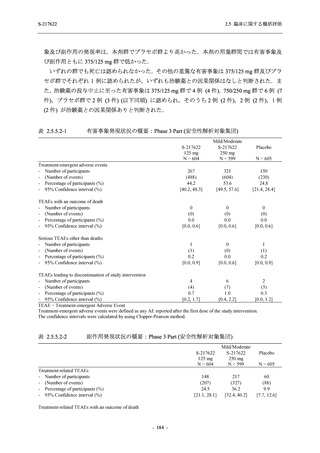
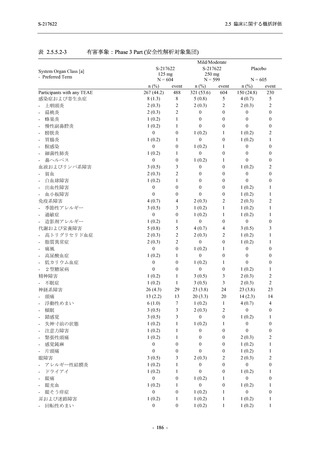
臨床症状改善効果が確認された
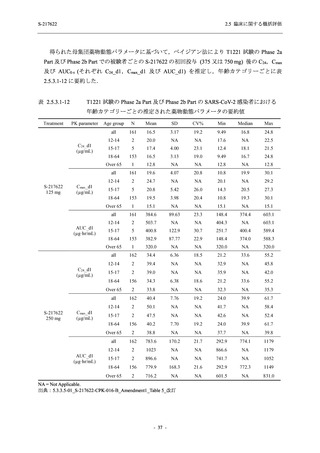
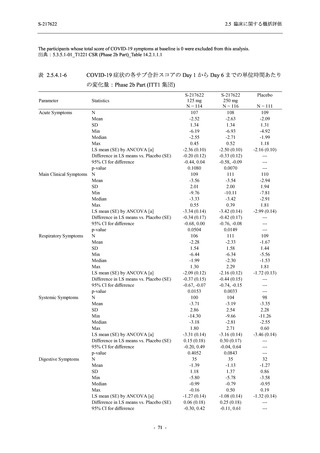
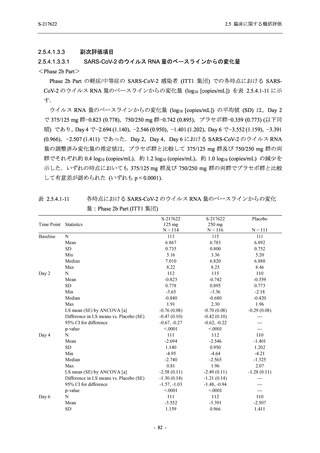
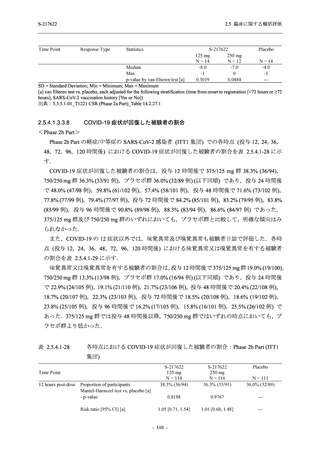
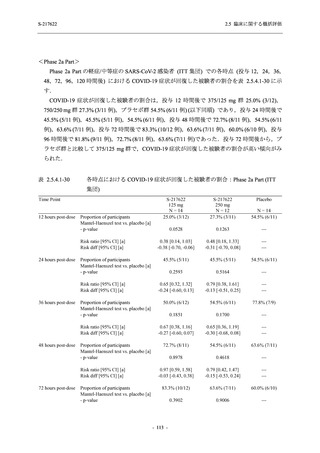
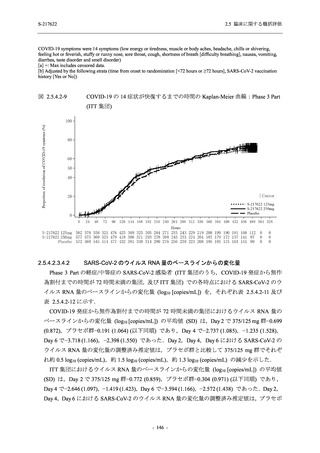
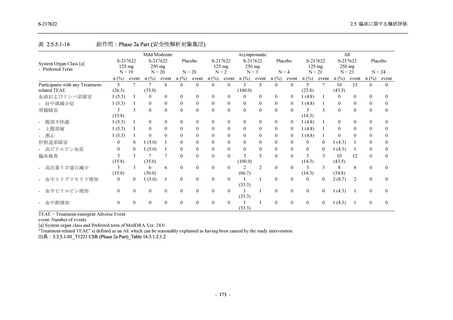
T1221 試験 Phase 2b Part において,COVID-19 の 12 症状合計スコアの Day 1 から Day 6 まで
の単位時間あたりの変化量は,375/125 mg 群及び 750/250 mg 群の両群でプラセボ群と比較して
有意差は認められなかったものの,調整済み変化量の推定値は,375/125 mg 群及び 750/250 mg
の両群でプラセボ群と比較して大きかった.Phase 2b Part の被験者集団ではベースラインのス
コアの平均値が 1 (軽度) 未満の症状が多く,1 (軽度) 以上であったのは,けん怠感 (疲労感),
熱っぽさ又は発熱,鼻水又は鼻づまり,喉の痛み,咳であった.これらの症状を含む,呼吸器
症状のサブ合計スコア (鼻水又は鼻づまり,喉の痛み,咳,息切れ [呼吸困難] の合計スコア)
の Day 1 から Day 6 までの単位時間あたりの変化量については,いずれの群においてもプラセ
ボ群との間で有意差が認められた.また,主な臨床症状 (鼻水又は鼻づまり,喉の痛み,咳,悪
寒/発汗,熱っぽさ又は発熱) 及び急性症状 (喉の痛み,咳,熱っぽさ又は発熱) でも,375/125 mg
群において有意差は認められなかったが,プラセボ群より改善する傾向がみられた.さらに,
事後解析として実施した,呼吸器症状に熱っぽさ又は発熱を加えた 5 症状について,いずれの
群においてもプラセボ群との間で有意差が認められた.
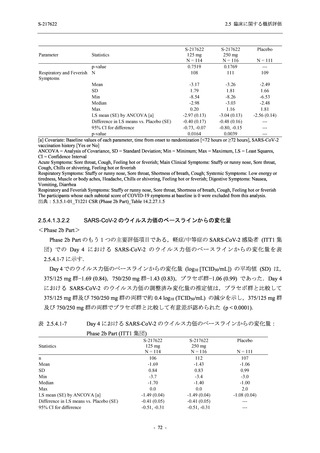
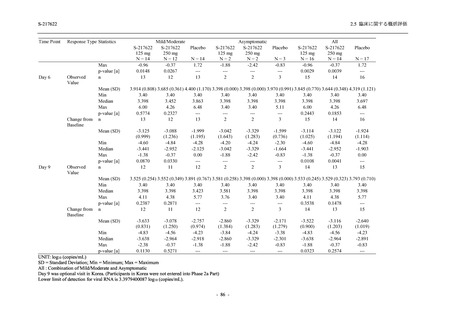
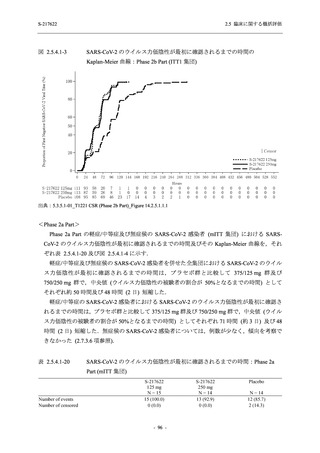
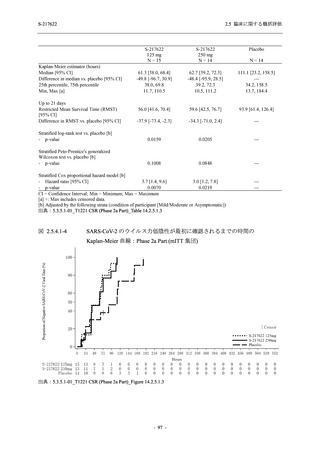
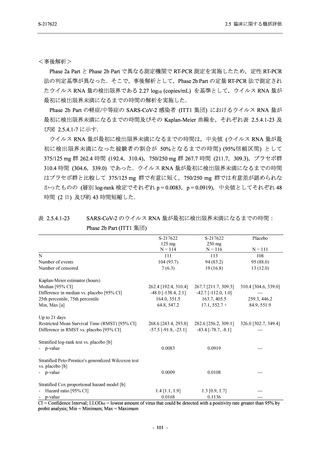
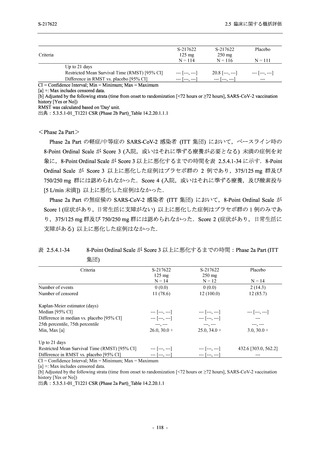
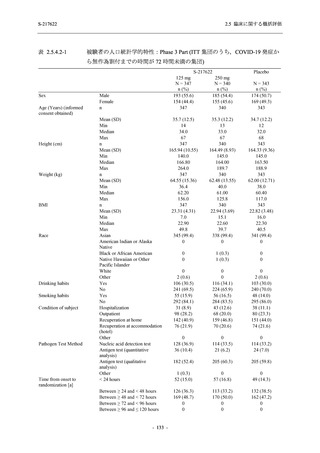
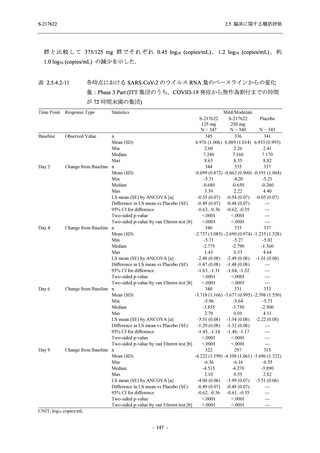
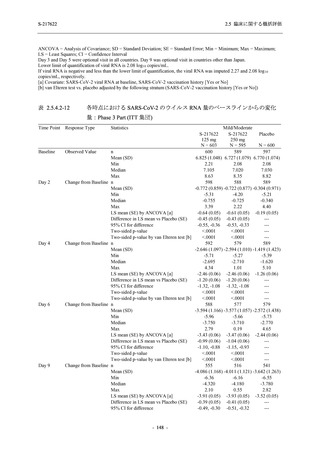
T1221 試験 Phase 2a Part において,軽症/中等症の SARS-CoV-2 感染者における COVID-19 症
状が回復するまでの時間は,中央値では群間で同程度であったものの,罹病期間の別の要約指
標である 21 日までを境界とする RMST はプラセボ群と比較して短縮される傾向がみられた
(2.5.4.1.3.3.6 項参照).また,COVID-19 の 12 症状合計スコアでは,投与 12 時間後からプラセボ
群よりも減少がみられ (2.5.4.1.3.3.7 項参照),COVID-19 症状が回復した被験者の割合でも,投
与 72 時間後から,プラセボ群と比較して高い傾向がみられた (2.5.4.1.3.3.8 項参照).
軽症/中等症の SARS-CoV-2 感染者において,抗ウイルス効果に加え,本剤投与による臨床症
状改善効果が確認された.
また,本邦ガイドライン [9] において,有症状者の場合の退院基準及び宿泊療養等の解除基
準は,以下のように定められている.
① 発症日から 10 日間経過し,かつ,症状軽快後 72 時間経過した場合,退院可能とする.
② 症状軽快後 24 時間経過した後,
PCR 検査または抗原定量検査で 24 時間以上間隔をあけ,
2 回の陰性を確認できれば,退院可能とする.
基準②では症状軽快後を起点としており,本剤投与による臨床症状改善効果は,入院又は宿
泊療養等による隔離期間を短縮することに寄与することが期待される.これにより,SARSCoV-2 感染による患者への負担及び医療資源の逼迫の軽減にも繋がると考える.
- 199 -