【資料No.1】2.5_臨床に関する概括資料 (183 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.5 臨床に関する概括評価
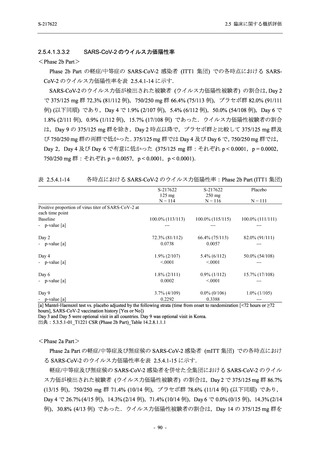
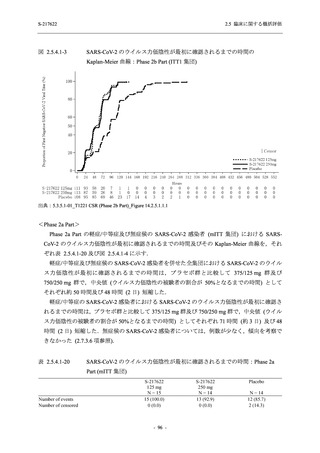
との因果関係はありと判断された.また,開鍵後に入手した情報を含む有害事象の発現率は,
375/125 mg 群 34.3% (48/140 例),750/250 mg 群 42.9% (60/140 例),プラセボ群 31.2% (44/141 例)
(以下同順) であり,副作用の発現率は 13.6% (19/140 例),22.1% (31/140 例),5.0% (7/141 例) で
あった.開鍵以降,死亡を含む重篤な有害事象は新たに認められなかった.
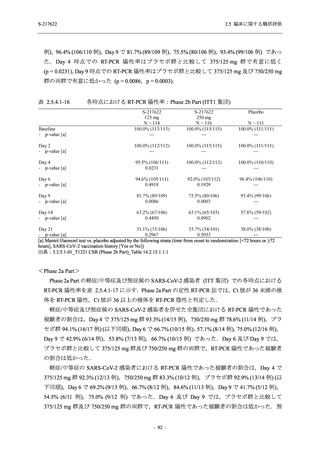
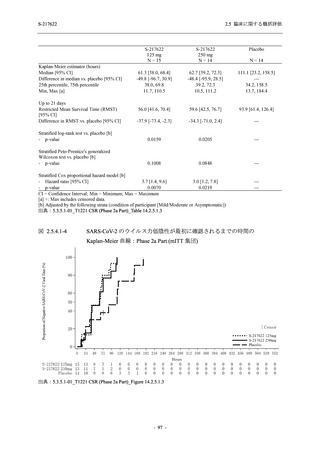
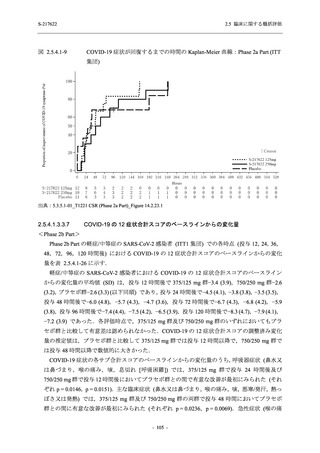
T1221 試験 Phase 2a Part において,死亡を含む重篤な有害事象,及び中止に至った有害事象
は報告されていない.軽症/中等症及び無症候の SARS-CoV-2 感染者を併せた全集団の有害事象
の発現率は,375/125 mg 群 52.4% (11/21 例),750/250 mg 群 69.6% (16/23 例),プラセボ群 37.5%
(9/24 例) (以下同順),副作用の発現率は 23.8% (5/21 例),43.5% (10/23 例),0% (0/24 例) であり,
本剤群の発現率はプラセボ群より高く,用量群間では 375/125 mg 群で低かった.いずれかの群
で 3 例以上に報告された有害事象は,375/125 mg 群で高比重リポ蛋白減少 (14.3% [3/21 例]),
750/250 mg 群で高比重リポ蛋白減少 (52.2% [12/23 例]),頭痛及び血中トリグリセリド増加 (そ
れぞれ 13.0% [3/23 例]) であり,高比重リポ蛋白減少及び血中トリグリセリド増加のほとんど
が副作用と判断された.
また,T1211 試験の健康成人で評価した用量において,2 例の被験者が有害事象により治験薬
の投与を中止したものの,本剤は概ね安全かつ忍容性は良好であった.
上記の結果は T1221 試験 Phase 2b Part の 421 例及び Phase 2a Part の 68 例での安全性,並びに
健康成人の情報であり,Phase 2b Part の開鍵以降の観察は参考情報であるものの,現時点では本
剤群で死亡を含む重篤な有害事象及び副作用は認められず,SARS-CoV-2 感染者における本剤
の 1 日 1 回 5 日間の経口投与 (1 日目は 375 mg,2 日目から 5 日目は 125 mg) での安全性に特
段の懸念は認められなかった.
2.5.5.2
T1221 試験 Phase 3 Part に基づく評価
SARS-CoV-2 感染者に対する本剤の安全性を,T1221 試験 Phase 3 Part の結果を用いて追加評
価した.
有害事象の定義及び安全性の評価方法は,
Phase 2a Part 及び Phase 2b Part と同様である (2.5.5.1
項参照).
2.5.5.2.1
患者集団及び曝露状況の概要
安全性解析対象集団は,治験薬を少なくとも 1 回投与された被験者からなる集団と定義し,
実際に初回投与された治験薬に基づき解析した.
2.5.5.2.2
有害事象
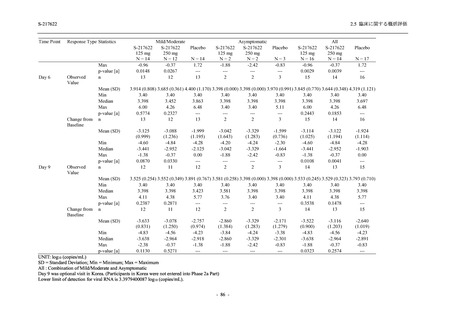
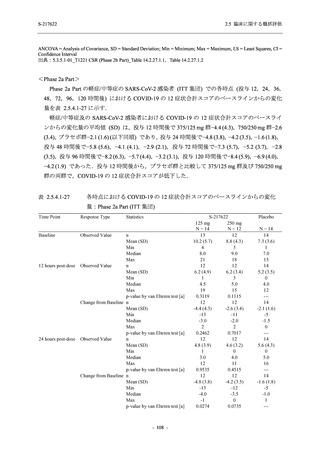
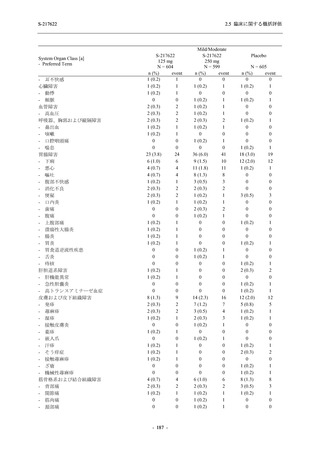
Phase 3 Part の有害事象及び副作用の発現状況の概要を,それぞれ表 2.5.5.2-1 及び表 2.5.5.2-2
に示す.
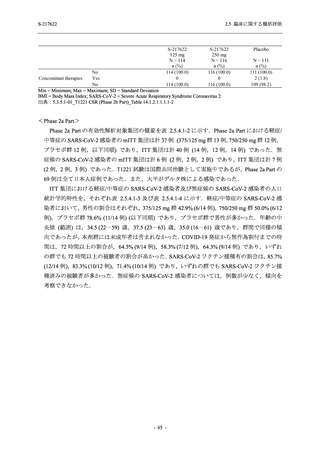
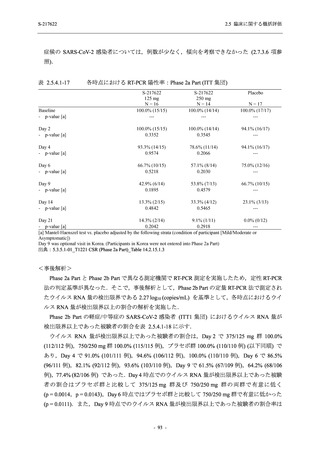
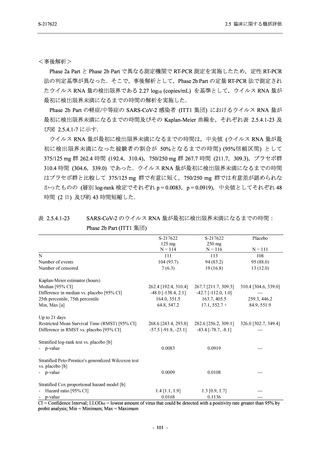
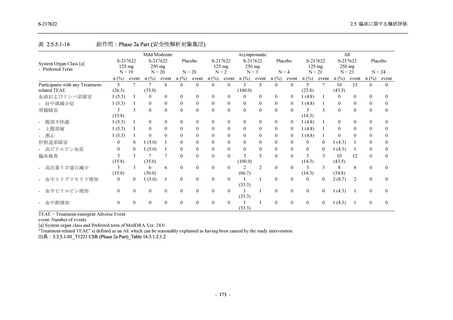
軽症/中等症の SARS-CoV-2 感染者の有害事象の発現率は,375/125 mg 群 44.2% (267/604 例),
750/250 mg 群 53.6% (321/599 例),プラセボ群 24.8% (150/605 例) (以下同順) であった.また,
副作用の発現率は,24.5% (148/604 例),36.2% (217/599 例),9.9% (60/605 例) であった.有害事
- 183 -