【資料No.1】2.5_臨床に関する概括資料 (167 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
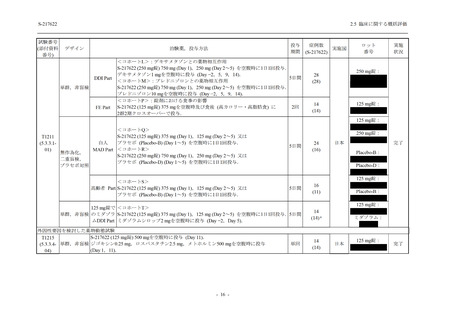
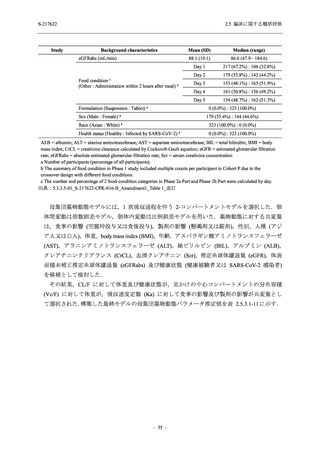
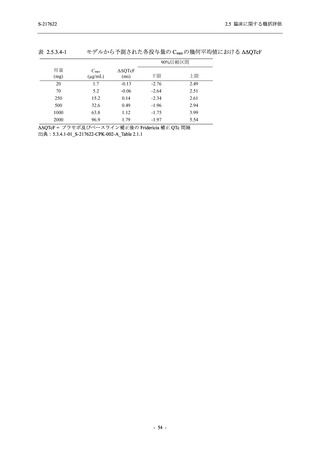
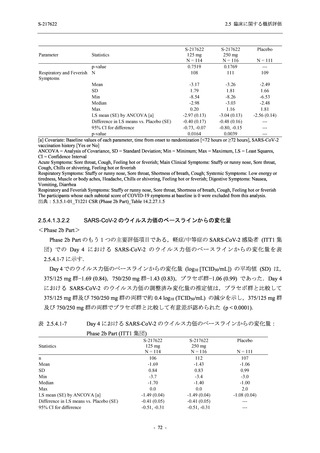
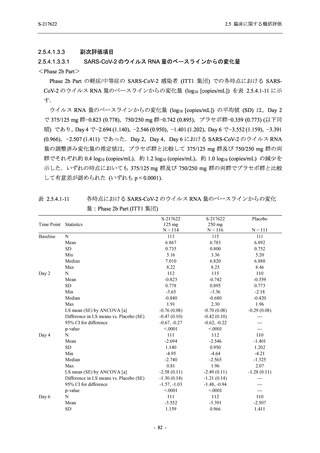
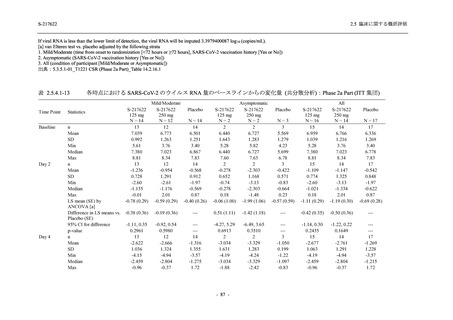
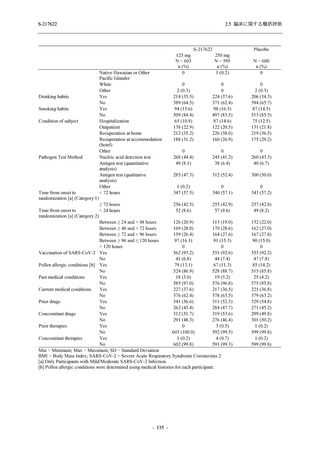
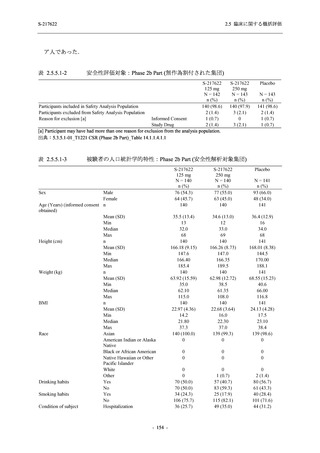
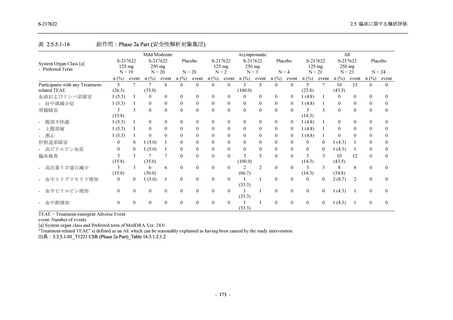
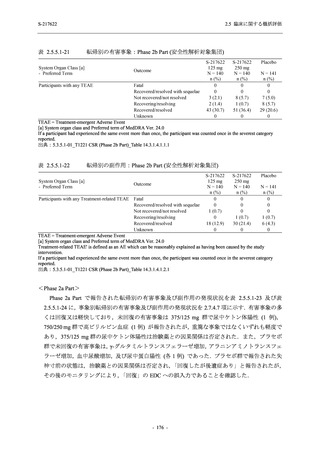
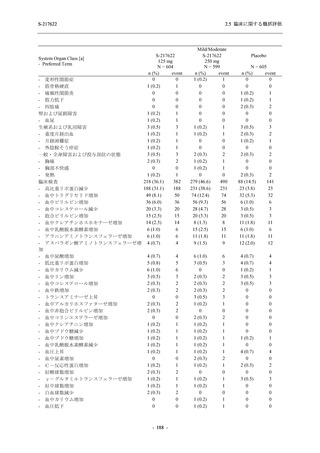
System Organ Class [a]
- Preferred Term
- 動悸
呼吸器、胸郭および縦隔障害
- 鼻出血
- 喀血
- 喘息
胃腸障害
- 下痢
- 悪心
- 嘔吐
- 腹部不快感
- 便秘
- 胃食道逆流性疾患
- 胃腸障害
- 上腹部痛
皮膚および皮下組織障害
- 発疹
- 皮膚乾燥
- 湿疹
- そう痒症
- ざ瘡
- 水疱
- 皮下出血
- 蕁麻疹
筋骨格系および結合組織障害
- 背部痛
- 関節痛
- 筋肉痛
- 四肢痛
- 椎間板突出
- 筋骨格硬直
生殖系および乳房障害
- 月経困難症
一般・全身障害および投与部位の状態
- 胸痛
臨床検査
- 高比重リポ蛋白減少
- 血中トリグリセリド増加
- アラニンアミノトランスフェラーゼ増
加
- 血中ビリルビン増加
- アスパラギン酸アミノトランスフェ
ラーゼ増加
- 血中鉄増加
- 抱合ビリルビン増加
- 血中コレステロール減少
- 血中乳酸脱水素酵素増加
- 血中尿酸増加
- 尿中ブドウ糖陽性
- 低比重リポ蛋白増加
- 肝酵素上昇
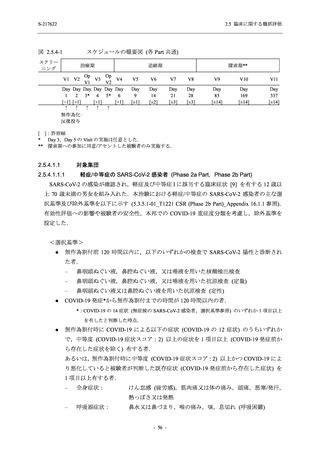
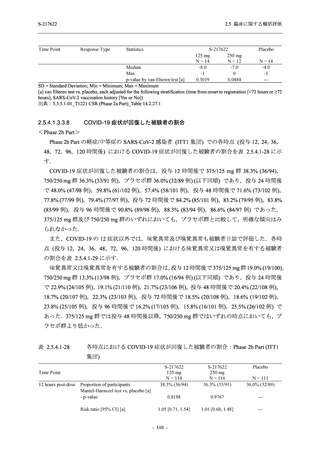
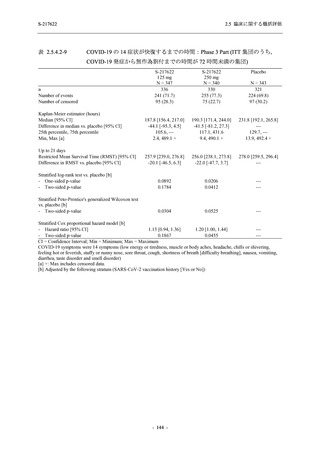
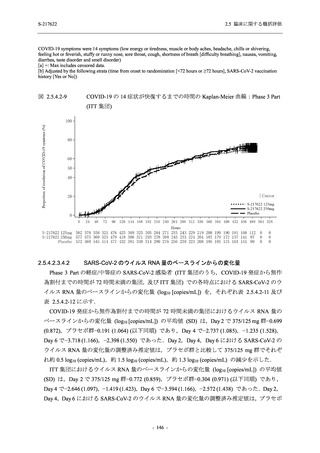
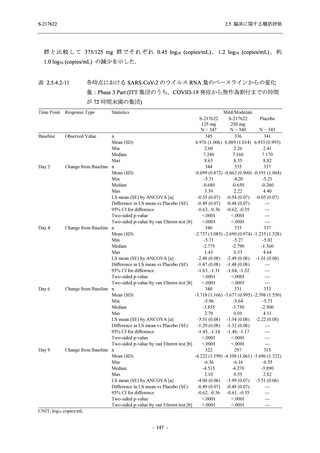
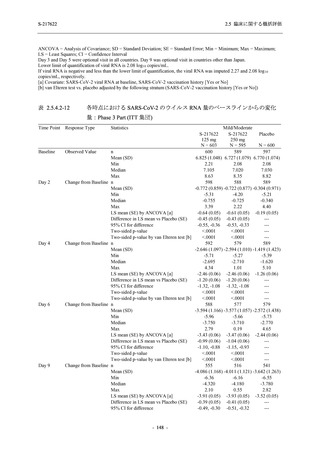
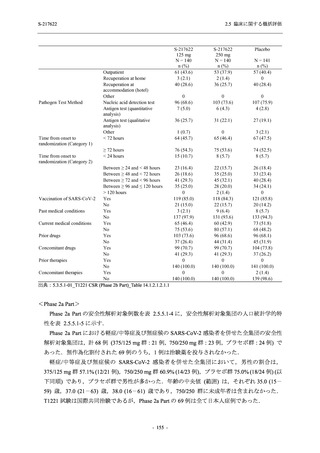
2.5 臨床に関する概括評価
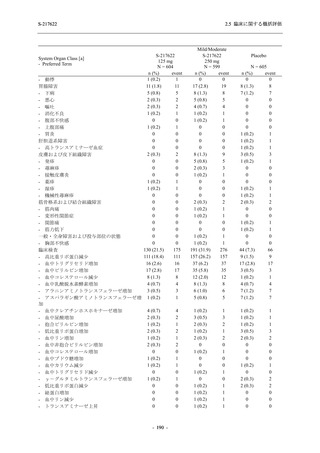
S-217622
125 mg
N = 140
n (%)
event
1 (0.7)
1
1 (0.7)
1
0
0
1 (0.7)
1
0
0
5 (3.6)
6
2 (1.4)
2
1 (0.7)
1
1 (0.7)
1
1 (0.7)
1
1 (0.7)
1
0
0
0
0
0
0
3 (2.1)
3
2 (1.4)
2
0
0
1 (0.7)
1
0
0
0
0
0
0
0
0
0
0
3 (2.1)
3
1 (0.7)
1
1 (0.7)
1
0
0
1 (0.7)
1
0
0
0
0
0
0
0
0
1 (0.7)
1
1 (0.7)
1
34 (24.3)
41
31 (22.1)
31
1 (0.7)
1
2 (1.4)
2
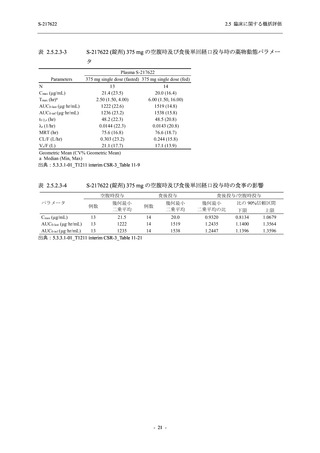
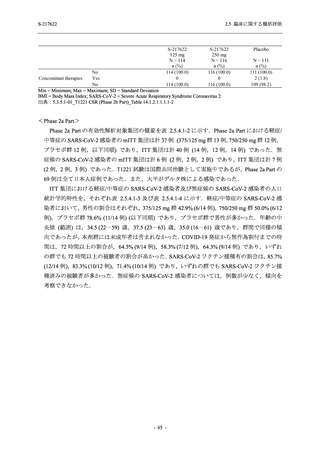
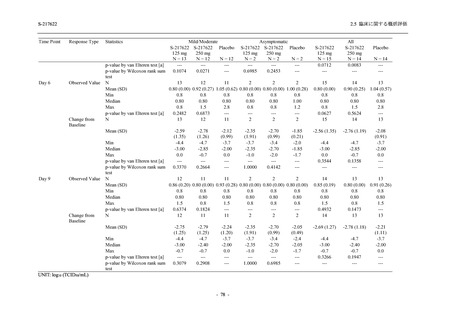
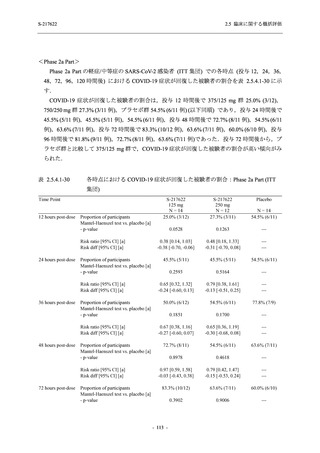
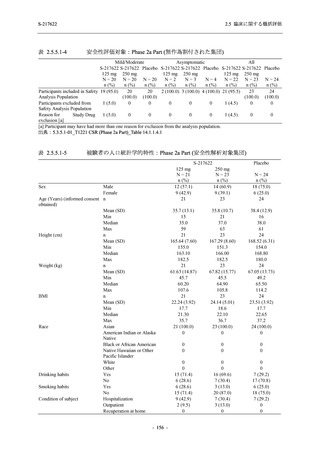
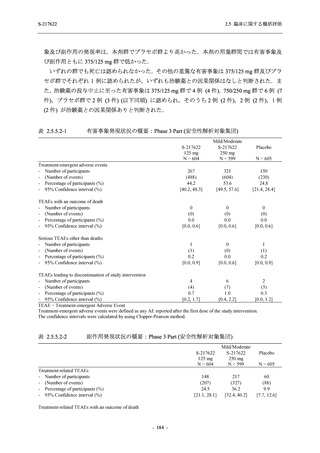
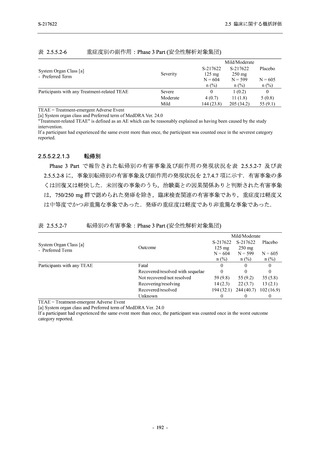
S-217622
250 mg
N = 140
n (%)
event
0
0
1 (0.7)
1
1 (0.7)
1
0
0
0
0
8 (5.7)
9
3 (2.1)
3
2 (1.4)
2
1 (0.7)
2
0
0
0
0
1 (0.7)
1
1 (0.7)
1
0
0
3 (2.1)
3
1 (0.7)
1
1 (0.7)
1
0
0
1 (0.7)
1
0
0
0
0
0
0
0
0
5 (3.6)
5
3 (2.1)
3
0
0
1 (0.7)
1
0
0
1 (0.7)
1
0
0
0
0
0
0
0
0
0
0
45 (32.1)
57
40 (28.6)
40
9 (6.4)
9
1 (0.7)
1
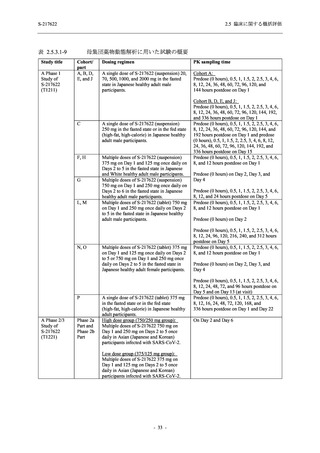
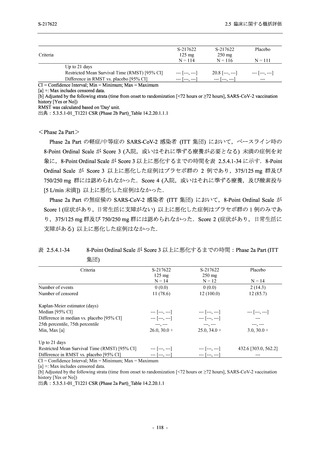
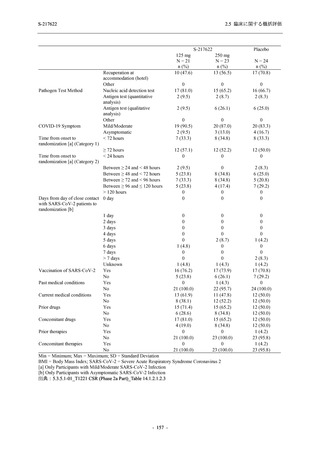
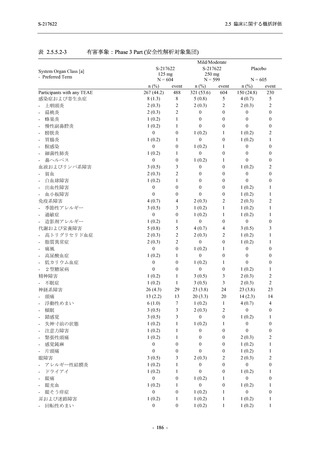
Placebo
N = 141
n (%)
event
1 (0.7)
1
2 (1.4)
2
1 (0.7)
1
0
0
1 (0.7)
1
7 (5.0)
7
1 (0.7)
1
1 (0.7)
1
0
0
0
0
0
0
0
0
1 (0.7)
1
4 (2.8)
4
8 (5.7)
9
3 (2.1)
3
1 (0.7)
1
1 (0.7)
1
0
0
1 (0.7)
1
1 (0.7)
1
1 (0.7)
1
1 (0.7)
1
3 (2.1)
3
1 (0.7)
1
0
0
0
0
0
0
1 (0.7)
1
1 (0.7)
1
1 (0.7)
1
1 (0.7)
1
0
0
0
0
12 (8.5)
13
5 (3.5)
5
1 (0.7)
1
1 (0.7)
1
1 (0.7)
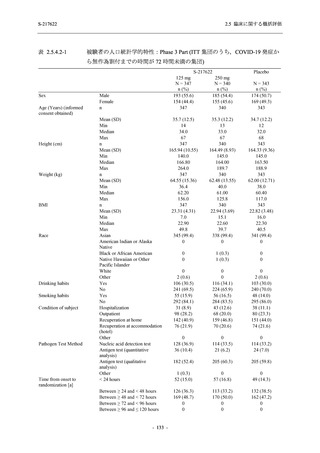
2 (1.4)
1
2
2 (1.4)
0
2
0
1 (0.7)
0
1
0
1 (0.7)
0
0
1 (0.7)
0
1 (0.7)
1 (0.7)
0
1
0
0
1
0
1
1
0
1 (0.7)
1 (0.7)
1 (0.7)
0
1 (0.7)
0
0
1 (0.7)
1
1
1
0
1
0
0
1
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
- 167 -