【資料No.1】2.5_臨床に関する概括資料 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.5 臨床に関する概括評価
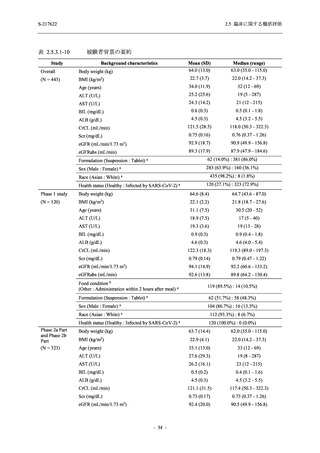
2.5.5.1.3
臨床検査値 ...................................................................................................... 180
2.5.5.1.4
部分集団における有害事象 .......................................................................... 180
2.5.5.1.5
健康成人における安全性 .............................................................................. 181
2.5.5.1.6
有害事象の予防,軽減,管理方法 .............................................................. 181
2.5.5.1.6.1
妊婦・授乳婦 .......................................................................................... 181
2.5.5.1.6.2
過量投与 .................................................................................................. 182
2.5.5.1.6.3
依存性・反跳現象・乱用 ...................................................................... 182
2.5.5.1.6.4
自動車運転及び機械操作に対する影響又は精神機能の障害 ........... 182
2.5.5.1.7
2.5.5.2
安全性評価のまとめ ...................................................................................... 182
T1221 試験 Phase 3 Part に基づく評価 ................................................................. 183
2.5.5.2.1
患者集団及び曝露状況の概要 ...................................................................... 183
2.5.5.2.2
有害事象 .......................................................................................................... 183
2.5.5.2.2.1
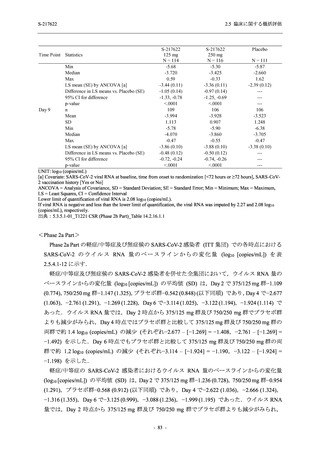
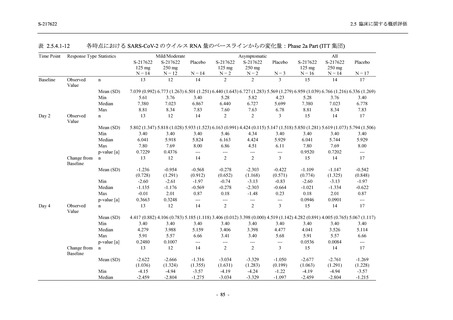
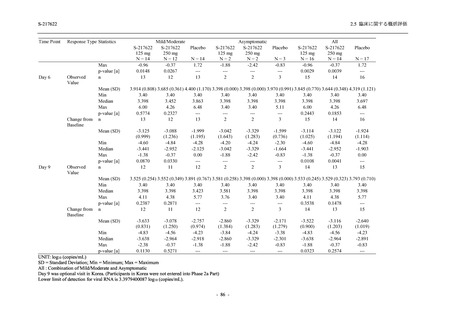
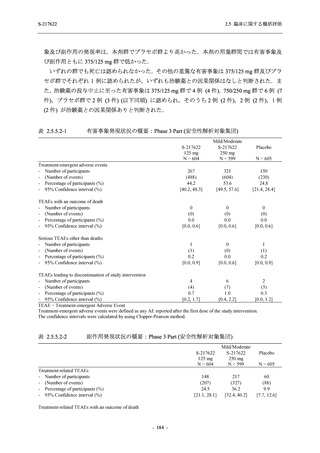
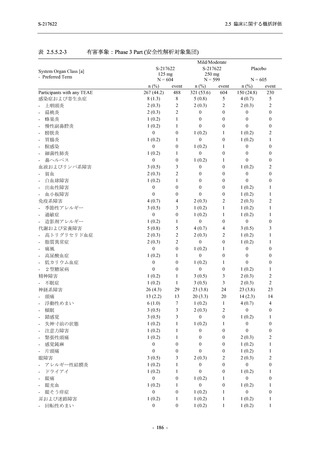
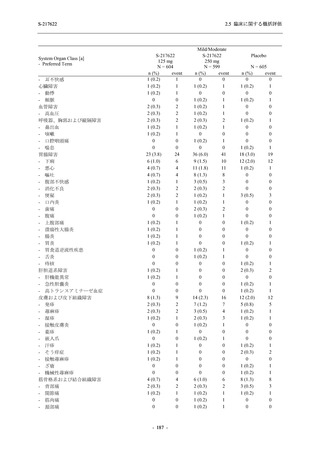
比較的よくみられる有害事象 .............................................................. 185
2.5.5.2.2.2
重篤な有害事象 ...................................................................................... 194
2.5.5.2.2.3
治験薬の投与中止に至った有害事象................................................... 194
2.5.5.2.2.4
特記すべき有害事象 .............................................................................. 194
2.5.5.2.3
臨床検査値 ...................................................................................................... 194
2.5.5.2.4
併合集団における有害事象 .......................................................................... 195
2.5.5.2.5
部分集団における有害事象 .......................................................................... 195
2.5.5.2.6
健康成人における安全性 .............................................................................. 195
2.5.5.2.7
有害事象の予防,軽減,管理方法 .............................................................. 195
2.5.5.2.8
安全性評価のまとめ ...................................................................................... 196
2.5.6
ベネフィットとリスクに関する結論 .......................................................................... 197
2.5.6.1
治療の背景 .............................................................................................................. 197
2.5.6.1.1
疾患又は症状 .................................................................................................. 197
2.5.6.1.2
現行の治療 ...................................................................................................... 197
2.5.6.2
ベネフィット .......................................................................................................... 198
2.5.6.2.1
ウイルス力価及びウイルス RNA 量に基づく,抗ウイルス効果が示
された .............................................................................................................. 198
2.5.6.2.2
臨床症状改善効果が確認された .................................................................. 199
2.5.6.2.3
1 日 1 回経口投与の抗ウイルス薬である.................................................... 200
2.5.6.2.4
複数の株に対して有効性が示唆されている............................................... 201
2.5.6.3
リスク ...................................................................................................................... 202
2.5.6.3.1
催奇形性 .......................................................................................................... 202
2.5.6.3.2
中等度以上の肝機能障害患者での安全性................................................... 202
2.5.6.3.3
全般的な安全性 .............................................................................................. 202
2.5.6.4
2.5.7
ベネフィット・リスク評価 .................................................................................. 203
参考文献 .......................................................................................................................... 205
- 4 -