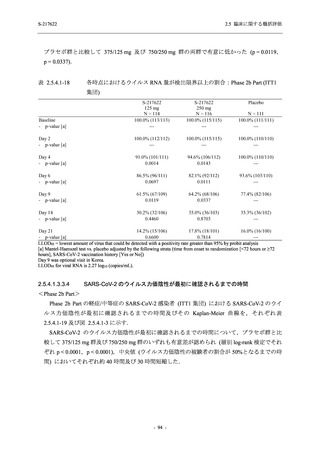
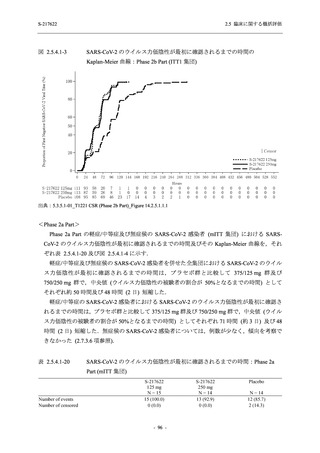
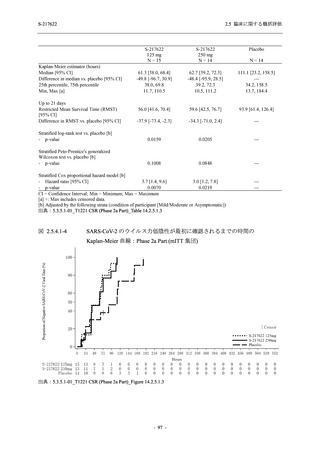
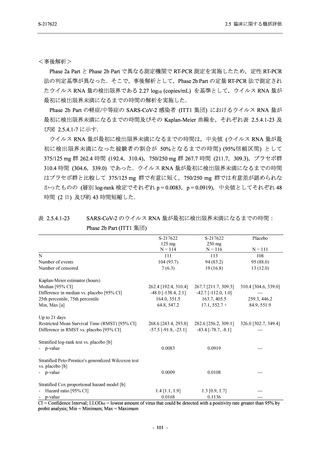
【資料No.1】2.5_臨床に関する概括資料 (202 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.5 臨床に関する概括評価
株],デルタ株 [Pango lineage B.1.617.2:hCoV-19/Japan/TY11-927-P1/2021 株],シータ株 (Pango
lineage P.3: hCoV-19/Japan/TY28-444/2021 株),ラムダ株 (Pango lineage C.37: hCoV-19/Japan/TY33456/2021 株),ミュー株 (Pangolineage B.1.621: hCoV-19/Japan/TY26-717/2021 株) 及びオミクロン
株 [Pango lineage B.1.1.529:hCoV-19/Japan/TY38-873/2021 株,hCoV-19/Japan/TY38-871/2021 株,
hCoV-19/Japan/TY40-385/2022 株,
hCoV-19/Japan/TY41-716/2022 株,hCoV-19/Japan/TY41-703/2022
株,hCoV-19/Japan/TY41-702/2022 株,hCoV-19/Japan/TY41-686/2022 株]) を感染させ,細胞変性
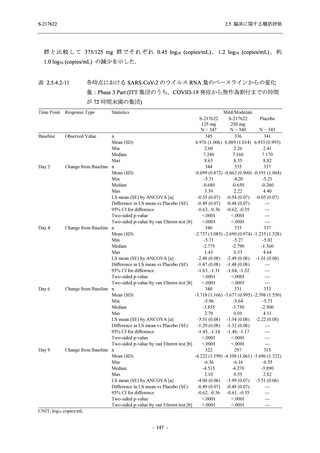
抑制効果を指標として S-217622 の抗ウイルス活性を評価した.S-217622 の SARS-CoV-2 臨床分
離株に対する 50%有効濃度は VeroE6/TMPRSS2 細胞では 0.22~0.52 µmol/L,HEK293T/ACE2TMPRSS2 細胞では 0.026~0.064 µmol/L であった.VeroE6/TMPRSS2 細胞及び HEK293T/ACE2TMPRSS2 細胞に対する 50%細胞障害濃度は > 100 µmol/L 及び 55 µmol/L であり,S-217622 は
スパイクタンパク質に変異が認められている複数の臨床分離株に対して抗 SARS-CoV-2 活性を
有し,臨床分離株に対する感受性の違いは株間で小さいこと,及び細胞障害を起こす濃度より
極めて低い濃度 (> 200 倍) で抗 SARS-CoV-2 活性を有することが示された (2.6.2.2.1.2 項参照).
2.5.6.3
2.5.6.3.1
リスク
催奇形性
臨床試験において,妊娠又は妊娠している可能性のある女性への本剤投与経験はないが,非
臨床試験において,ウサギの生殖発生毒性試験で母動物に毒性が認められた用量 (臨床曝露量
の 5.0 倍相当以上) で胎児の軸骨格の形態異常が認められた (2.6.6.6.3 項参照).胎児の骨格形態
異常は致命的な転帰となる可能性があるため,医薬品リスク管理計画書 (J-RMP) において,催
奇形性を重要な潜在的リスクとして設定した.市販後では,通常の医薬品安全性監視活動を介
して,本剤の投与状況,妊婦,胎児及び出生児の詳細な情報を収集するとともに,添付文書,
患者向医薬品ガイド,及び医療従事者向け資材で注意喚起することでリスク最小化活動を行う.
2.5.6.3.2
中等度以上の肝機能障害患者での安全性
中等度以上の肝機能障害患者での投与経験はなく,主な消失過程が肝代謝であることを踏ま
えると,中等度以上の肝機能障害患者では,本剤の曝露量が上昇し,安全性及び忍容性が確認
されている曝露量を大きく超える可能性が考えられるため,J-RMP 上の重要な不足情報として
設定した.通常の医薬品安全性監視活動を介して,添付文書及び患者向け医薬品ガイドで注意
喚起を行うとともに,肝機能障害を有する被験者を対象とした臨床薬理試験を実施する.
2.5.6.3.3
全般的な安全性
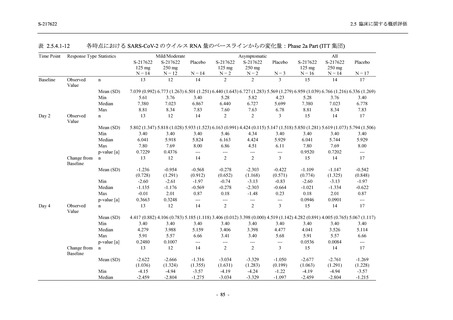
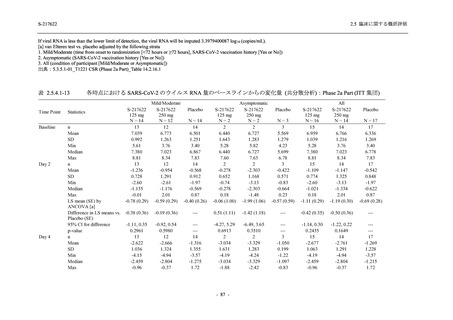
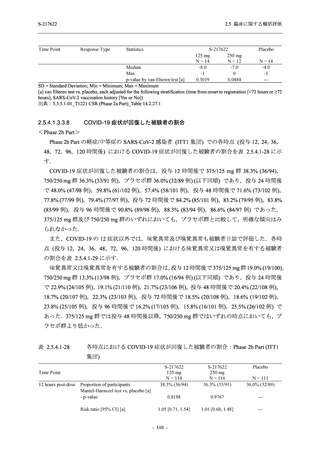
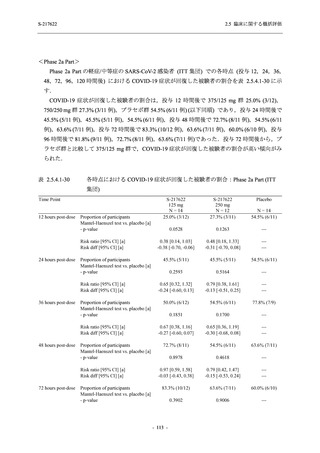
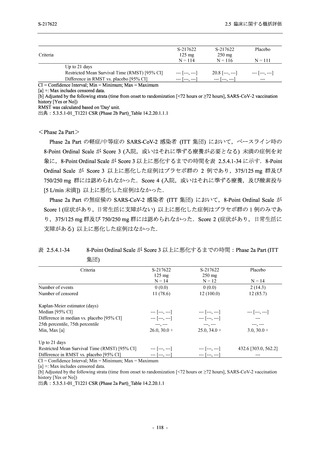
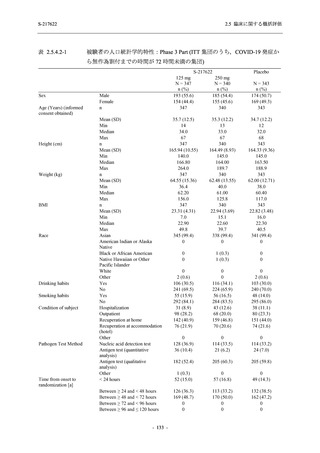
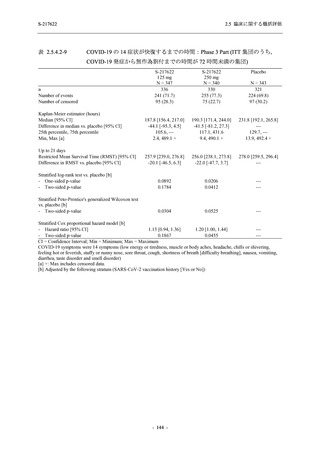
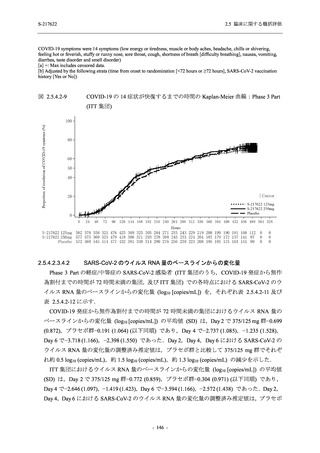
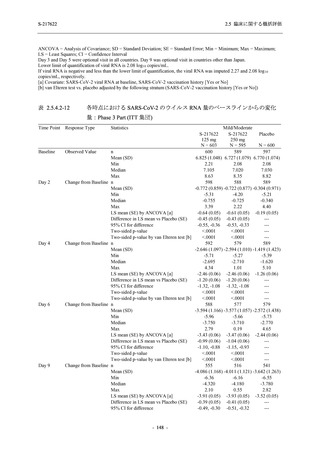
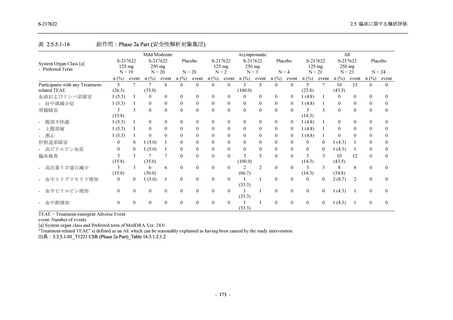
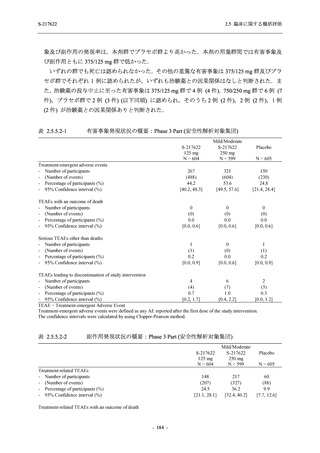
T1221 試験 Phase 2b Part 及び Phase 2a Part を併合した申請用法用量 (375/125 mg 群) で 2%以
上に報告された有害事象は,高比重リポ蛋白減少 (21.1% [34/161 例]),頭痛 (2.5% [4/161 例]) で
あり,そのうち 9.9% (16/161 例),0.6% (1/161 例) が因果関係ありと判断された.
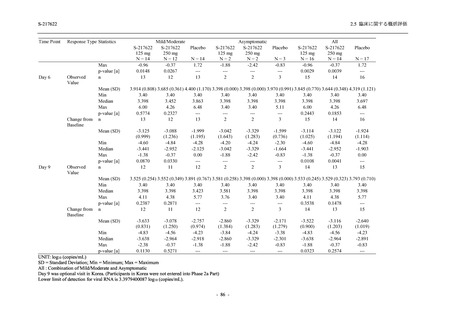
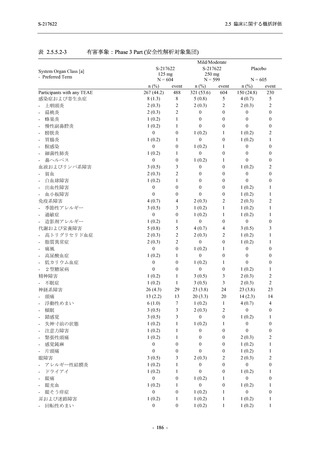
Phase 2b Part において,本剤群で死亡を含む重篤な有害事象は認められていない (2.5.5.1.2.2
項参照).開鍵までにおいて,申請用法用量 (375/125 mg 群) で 2%以上に報告された有害事象
は,高比重リポ蛋白減少 (16.4% [23/140 例]) のみであり,5.7% (8/140 例) が因果関係ありと判
- 202 -