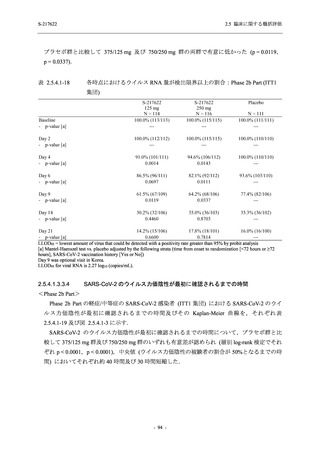
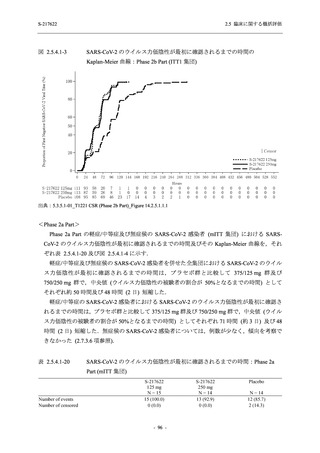
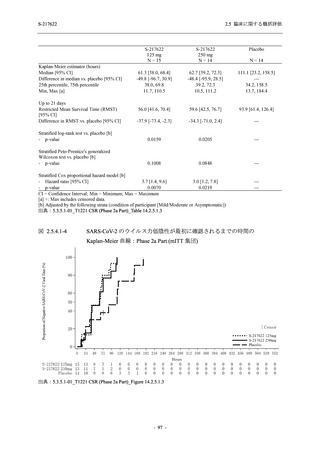
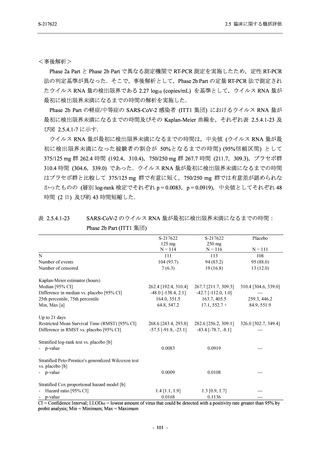
【資料No.1】2.5_臨床に関する概括資料 (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.5 臨床に関する概括評価
な状況が続くと予想され,感染予防の継続に加え,変異株を含めた SARS-CoV-2 に有効な治療
薬の開発が強く望まれている.
これらのことから,これまでの日常生活を取り戻す上で,COVID-19 の収束は極めて重要であ
る.SARS-CoV-2 の感染拡大を抑制するため,感染初期の患者に対して治療機会を広く提供する
ために,重症化リスクを有しない軽症又は無症候の患者も対象とする,自宅で簡便に服薬可能
な経口の抗ウイルス薬開発の必要性は,非常に高いと考えられる.
COVID-19 の治療法及びその課題の変化に伴い,追記する.
2022 年 10 月 4 日時点で,本邦では,ウイルス RNA ポリメラーゼ阻害剤のレムデシビル及び
モルヌピラビル,3C-Like プロテアーゼ阻害剤のニルマトレルビル・リトナビル,SARS-CoV-2
中和抗体薬のカシリビマブ/イムデビマブ,ソトロビマブ及びチキサゲビマブ/シルガビマブ,
JAK 阻害剤のバリシチニブ,IL-6 受容体抗体のトシリズマブなどが SARS-CoV-2 感染症治療薬
として承認されている.
中和抗体薬では,オミクロン株に対する有効性が減弱するおそれがあることから,他の治療
薬が使用できない場合に投与を検討することとされている.
経口の抗ウイルス薬としてモルヌピラビル及びニルマトレルビル・リトナビルの 2 剤が特例
承認を取得しているが,これらの承認はワクチン未接種かつ重症化リスク因子を有する患者を
対象とした,デルタ株以前の流行株での臨床試験成績に基づいており,現在のワクチン接種率
(80%超) [38] や変異株 (オミクロン株が主流),重症化リスク因子の有無を問わない集団に対し
て,症状改善や消失などの臨床上の症状改善効果を示した経口の抗ウイルス薬は未だない.
また,本邦の SARS-CoV-2 感染症患者は軽症から中等症 I が大多数を占めているものの,軽
症から中等症 I を対象とした治療薬及び治療法は,原則として重症化リスク因子を有する患者
に使用されるべきとして使用範囲が限定的である.現在主流のオミクロン株はデルタ株以前の
株による感染例と比較して症状が軽いものの,感染力が高いことから,家庭内感染や自宅隔離
患者が増加し,医療の逼迫や経済活動の制限等が社会的な問題となっている.こうした状況か
ら,医療機関や保健所の負担を減らすために,感染症法の分類を新型コロナ感染症は現在の 2
類相当からインフルエンザと同様の 5 類へ変更することも検討されており,自宅等でも簡便に
使用可能で,重症化リスク因子の有無やワクチン接種の有無にかかわらず使用可能である経口
の抗ウイルス薬に対する社会的ニーズが高まっている.
2.5.1.3
臨床開発計画
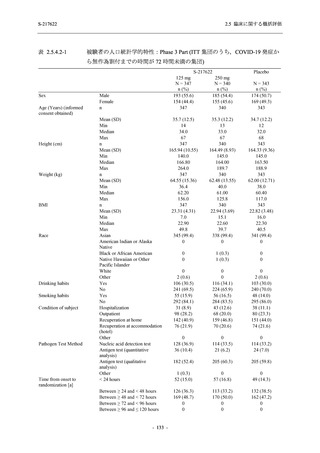
S-217622 は,SARS-CoV-2 感染マウスモデルにおいて用量依存的な肺内ウイルス力価の低下
が確認され (2.4.2.1.3 項参照),2021 年 7 月から臨床試験を開始した.2022 年 6 月 7 日現在,本
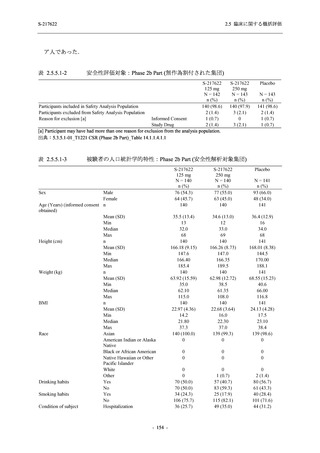
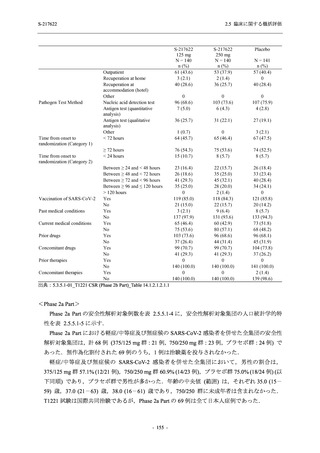
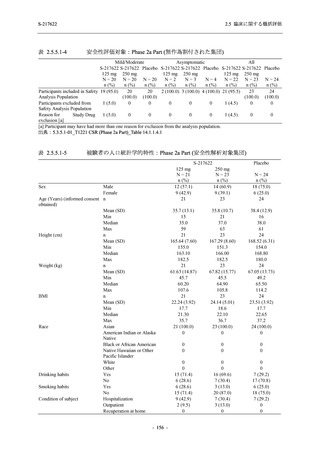
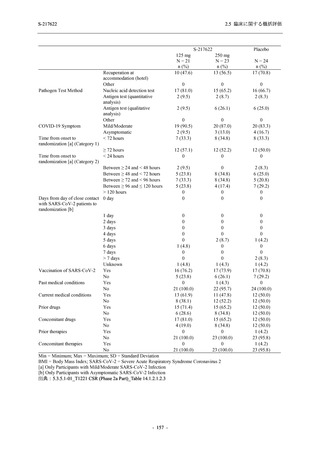
剤の開発パッケージの一環として,第 1 相試験を 1 試験完了し,第 1 相試験及び第 2/3 相試験
を各 1 試験実施している (表 2.5.1.4-1 参照).なお,本剤の開発及び臨床試験は,医薬品医療機
器総合機構との事前面談において,相談及び協議の上,計画実施した.
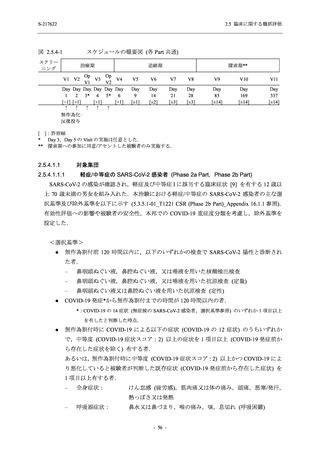
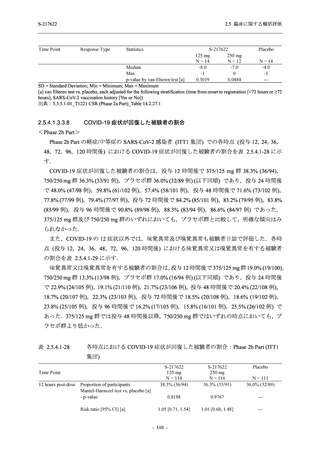
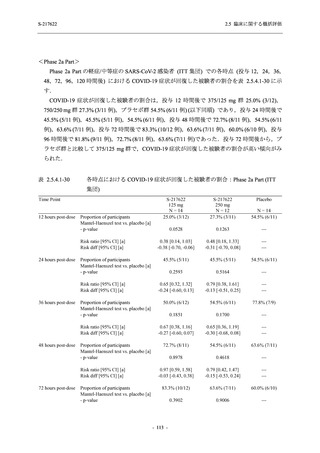
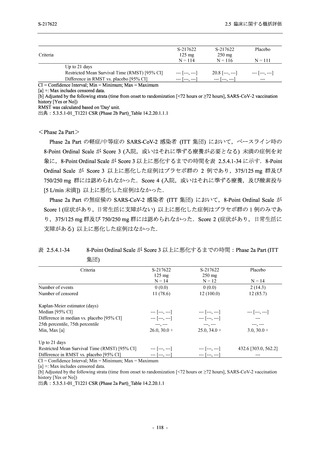
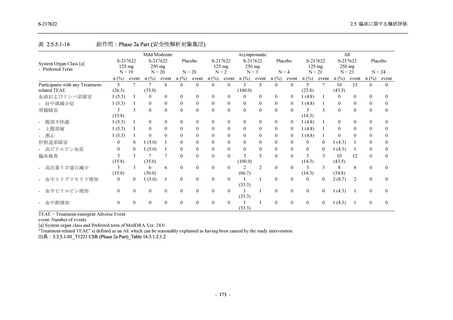
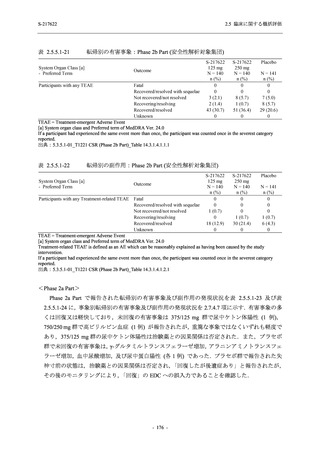
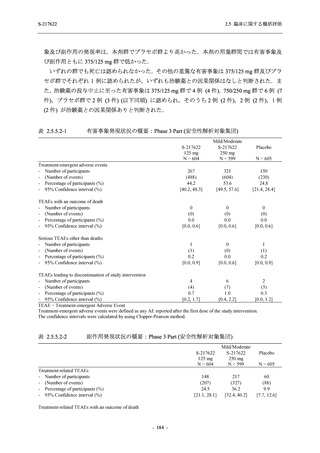
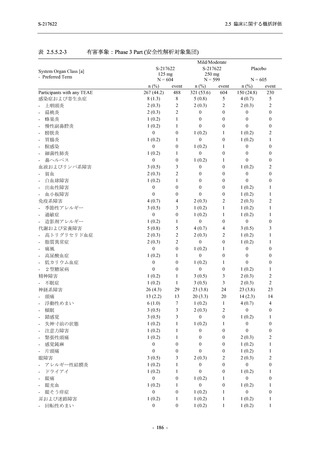
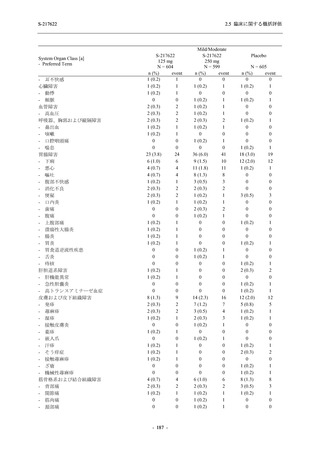
2021 年 7 月から開始した健康成人対象第 1 相試験 (以下,T1211 試験) において,本剤の懸
濁剤を用いた単回漸増投与,1 日 1 回 5 日間の反復漸増投与を行い,評価した用量までの健康
- 13 -