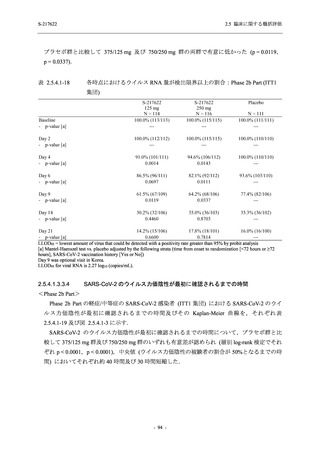
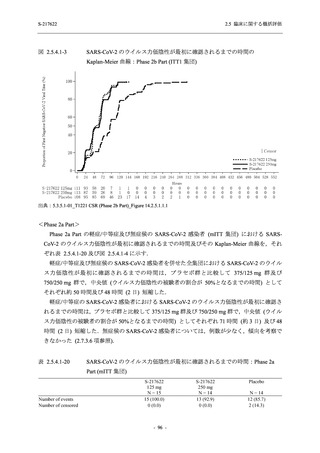
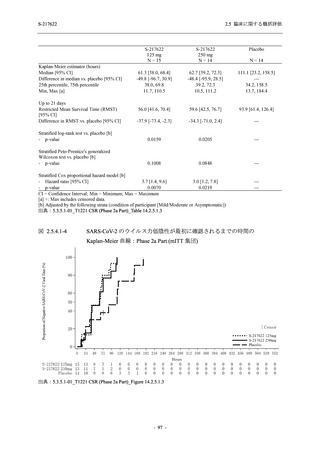
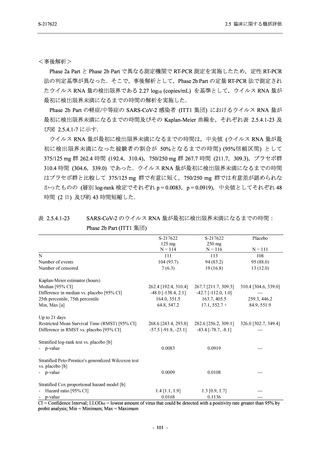
【資料No.1】2.5_臨床に関する概括資料 (195 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.5 臨床に関する概括評価
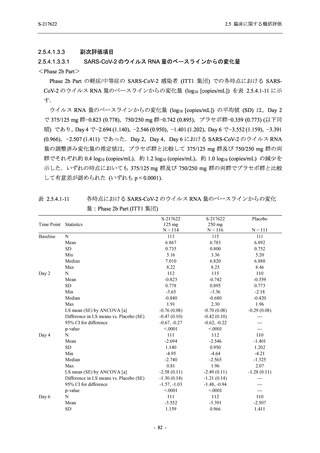
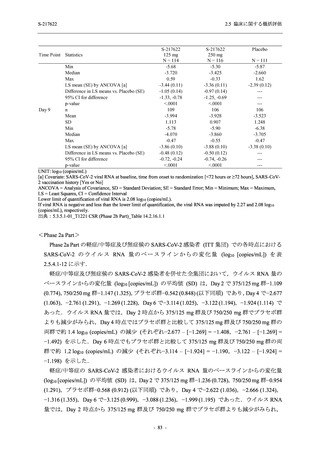
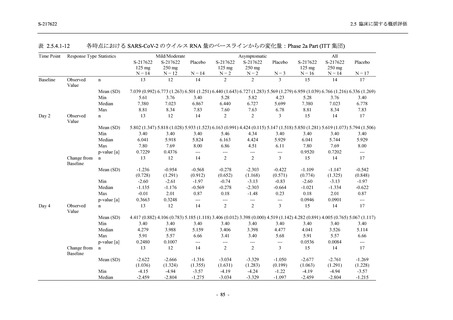
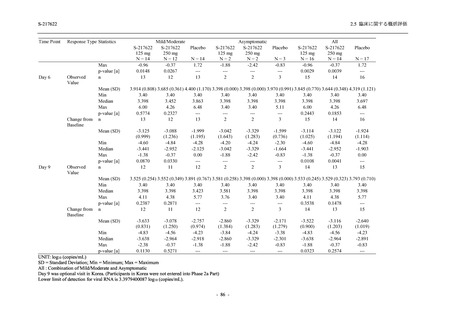
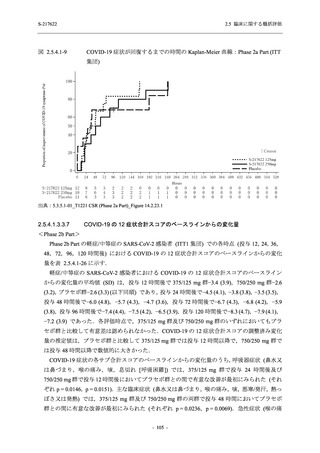
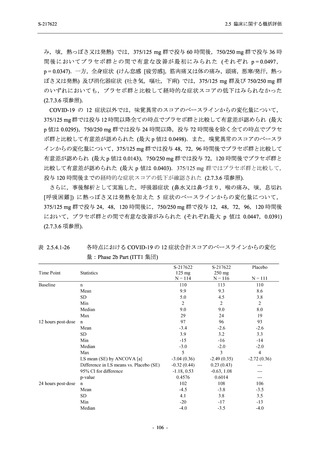
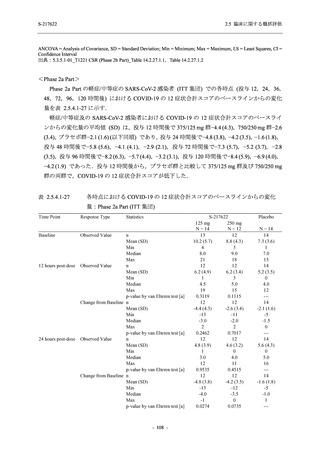
は Day 14 でベースラインからの変化量が本剤群とプラセボ群で同程度であったため,一時的な
変動と考えられた.これらの検査値について,用量間では,375/125 mg 群に比べ 750/250 mg 群
の方が上昇 (増加) 又は低下 (減少) の程度が大きかった (2.7.4.3.2 項参照).
2.5.5.2.4
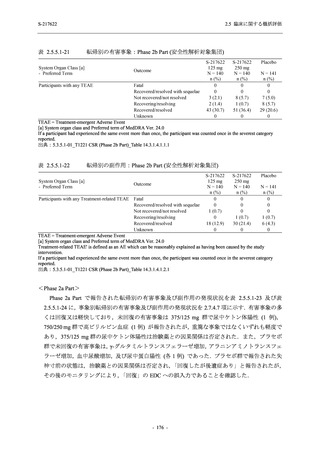
併合集団における有害事象
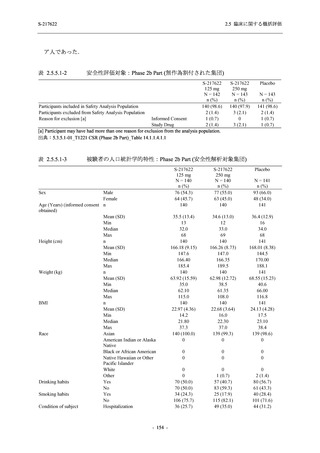
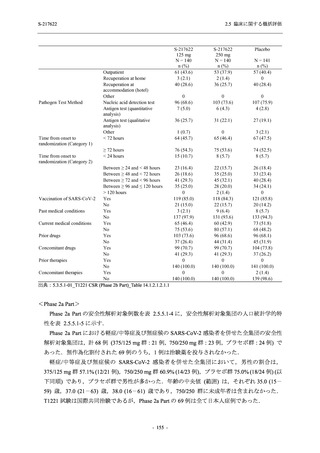
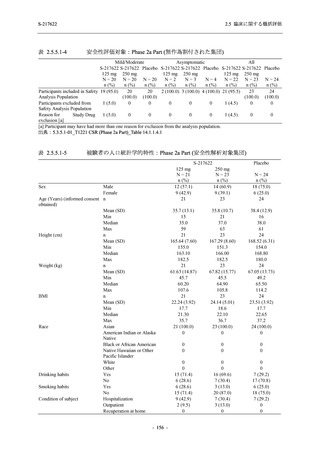
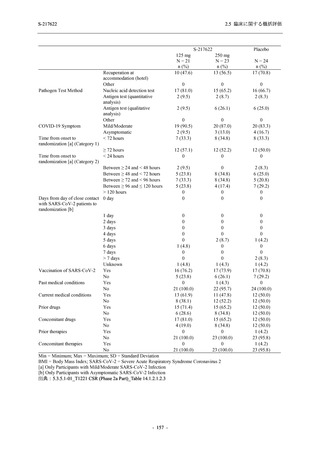
T1221 試験 Phase 2a Part,Phase 2b Part,及び Phase 3 Part を併合した集団において,有害事象
の発現率は 375/125 mg 群で 42.6% (325/763 例),750/250 mg 群で 52.0% (395/759 例),プラセボ
群で 26.8% (205/766 例) (以下同順),副作用の発現率は 22.5% (172/763 例),33.6% (255/759 例),
8.7% (67/766 例) であった.有害事象及び副作用の発現率は,本剤群でプラセボ群より高かった
が,ほとんどの有害事象は軽度で,回復又は軽快した.本剤の用量群間では有害事象及び副作
用ともに 375/125 mg 群で低かった.
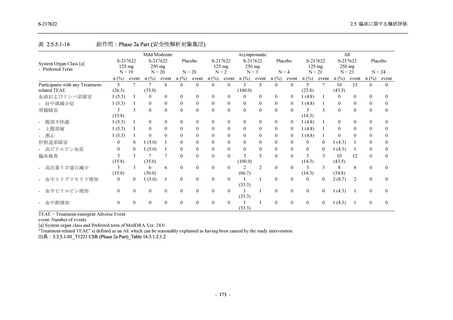
いずれの群においても 2%以上に報告された有害事象は,頭痛を除き,全て臨床検査関連の有
害事象であった (T1221 (Phase 3 Part)_Table 14.3.1.2.5.1, 2 参照).本剤の用量群間では,有害事象
及び副作用の発現率はいずれの事象でも 375/125 mg 群で低かった.
T1221 試験 Phase 2a Part,Phase 2b Part,及び Phase 3 Part を併合した集団でも,Phase 3 Part の
結果と同様の傾向であった.
2.5.5.2.5
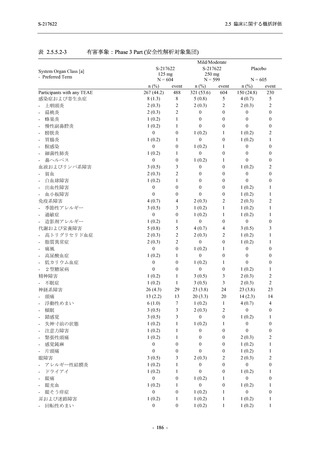
部分集団における有害事象
Phase 2a Part,Phase 2b Part,及び Phase 3 Part の軽症/中等症の SARS-CoV-2 感染者を併合した
評価において,18 歳未満の被験者では,375/125 mg 群 11 例,750/250 mg 群 16 例,プラセボ群
22 例が安全性解析対象集団に含まれた.18 歳未満の被験者で認められた有害事象はいずれも軽
度であった.報告された有害事象に小児特有の傾向は認められなかった.65 歳以上の被験者で
は,375/125 mg 群 5 例,750/250 mg 群 7 例,プラセボ群 8 例が安全性解析対象集団に含まれた.
65 歳以上の被験者で認められた有害事象は,プラセボ群の 1 例に認められたそう痒症 1 件を除
き,いずれも軽度であった.報告された有害事象に高齢者特有の傾向は認められなかった
(T1221 (Phase 3 Part)_Table 14.3.1.3.8.1.4.1-3,14.3.1.3.8.2.4.1-3 参照).
また,Phase 2a Part,Phase 2b Part,及び Phase 3 Part の軽症/中等症の SARS-CoV-2 感染者を併
合した評価において,日本人は,375/125 mg 群 496 例,750/250 mg 群 468 例,プラセボ群 478
例が安全性解析対象集団に含まれ,日本人特有の安全性の懸念は認められなかった (T1221
(Phase 3 Part)_Table 14.3.1.3.8.1.1.1,14.3.1.3.8.2.1.1,14.3.1.4.8.1.1.1,14.3.1.4.8.2.1.1 参照).
2.5.5.2.6
健康成人における安全性
Phase 3 Part の結果に基づく追加情報はない.
2.5.5.2.7
有害事象の予防,軽減,管理方法
Phase 3 Part の結果を踏まえ,変更なし.
- 195 -