【資料No.1】2.5_臨床に関する概括資料 (191 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
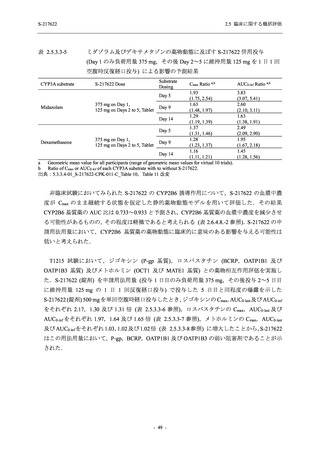
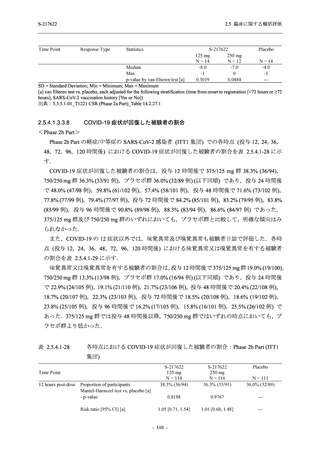
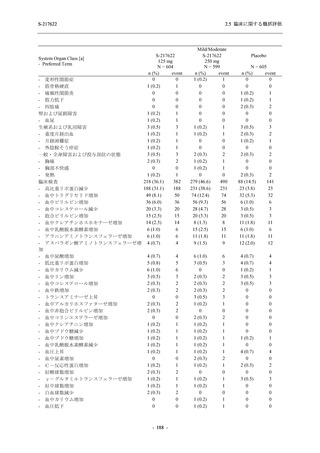
2.5 臨床に関する概括評価
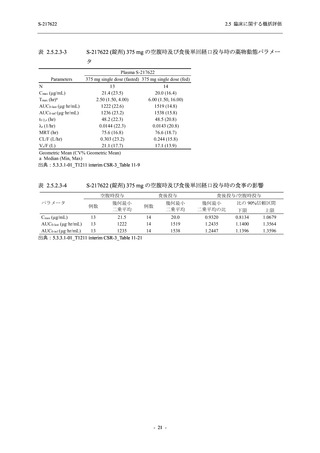
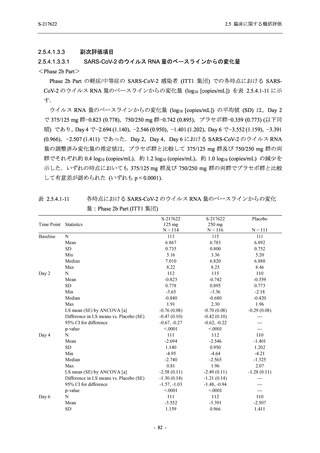
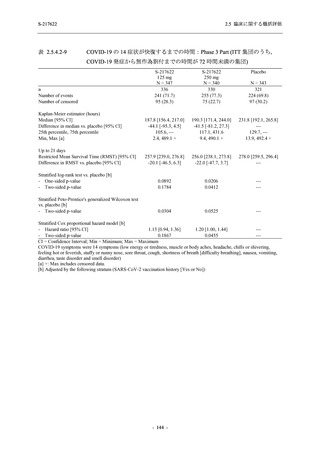
S-217622
125 mg
N = 604
n (%)
event
0
0
0
0
0
0
0
0
0
0
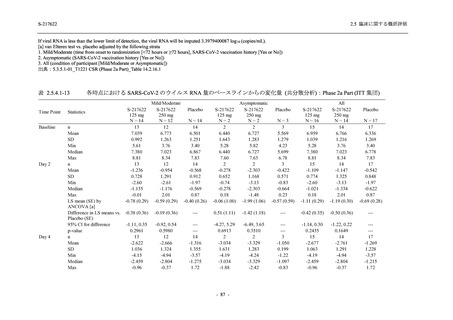
System Organ Class [a]
- Preferred Term
Mild/Moderate
S-217622
250 mg
N = 599
n (%)
event
1 (0.2)
1
0
0
0
0
0
0
0
0
Placebo
N = 605
n (%)
event
0
0
2 (0.3)
2
1 (0.2)
1
1 (0.2)
1
1 (0.2)
1
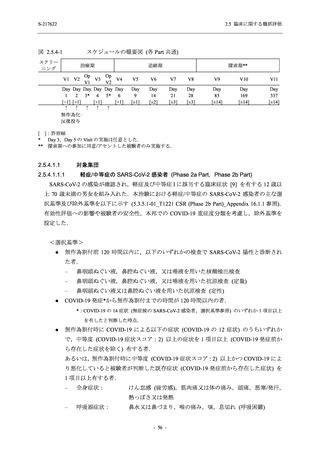
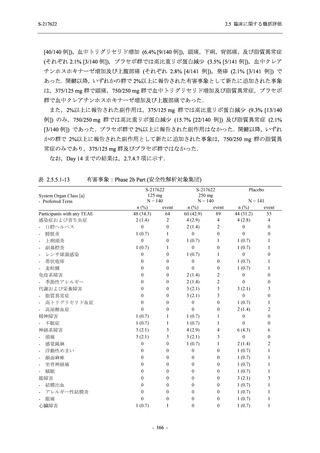
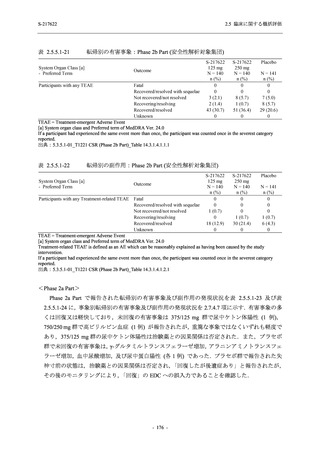
- 血中アルカリホスファターゼ増加
- C-反応性蛋白増加
- フィブリンDダイマー増加
- 好中球数減少
- 尿中ウロビリノーゲン増加
TEAE = Treatment-emergent Adverse Event
event: Number of events
[a] System organ class and Preferred term of MedDRA Ver. 24.0
"Treatment-related TEAE" is defined as an AE which can be reasonably explained as having been caused by the study
intervention.
2.5.5.2.2.1.2
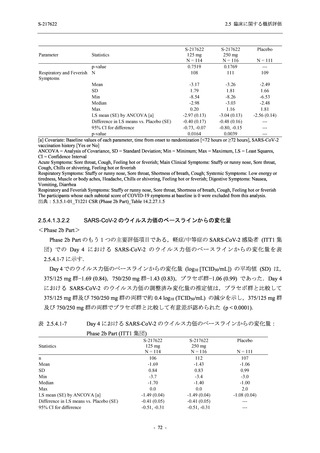
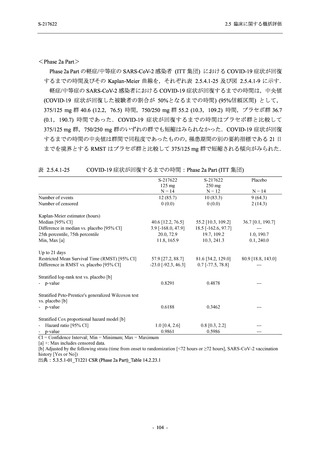
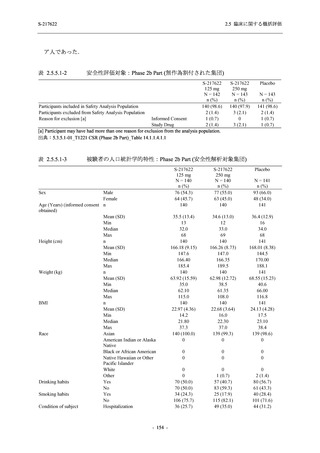
重症度別
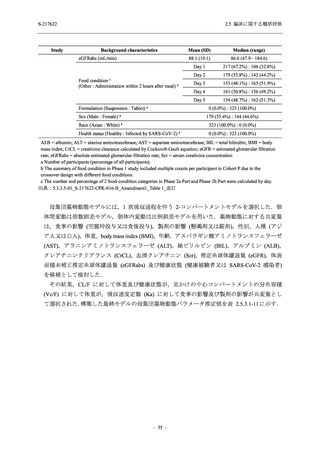
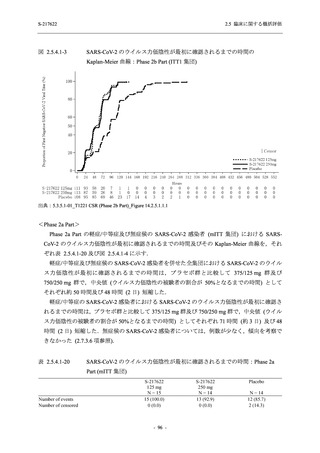
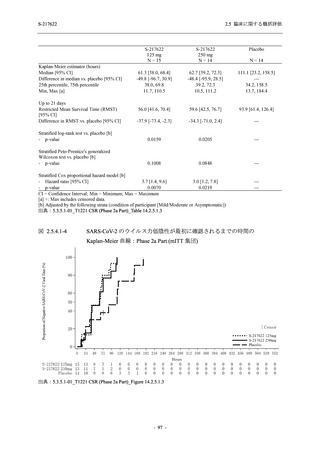
Phase 3 Part で報告された重症度別の有害事象及び副作用の発現状況を表 2.5.5.2-5 及び表
2.5.5.2-6 に,事象別重症度別の有害事象及び副作用の発現状況を 2.7.4.7 項に示す.
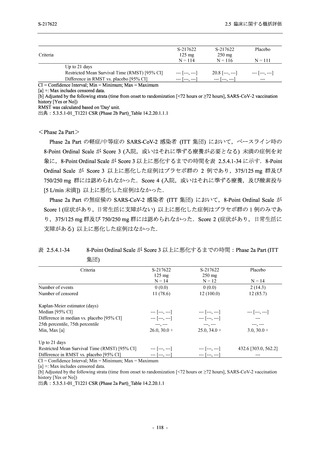
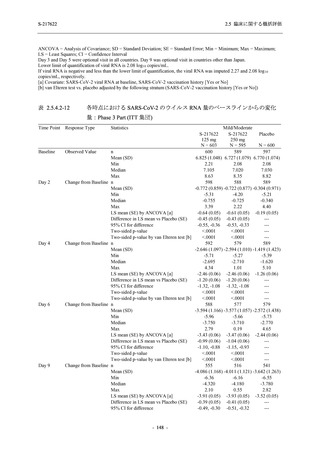
有害事象のほとんどは軽度であり,高度の事象は 375/125 mg 群で重度月経出血が 1 例,
750/250 mg 群で頭痛が 1 例,
プラセボ群で下痢及び急性胆嚢炎がそれぞれ 1 例に認められたが,
頭痛を除きいずれの事象も治験薬との因果関係はなしと判断された.750/250 mg 群の頭痛は
Day 1 に発現し,治験薬との因果関係ありと判断されたが,パラセタモール投与により Day 4 に
回復し,治験薬の投与は継続された.
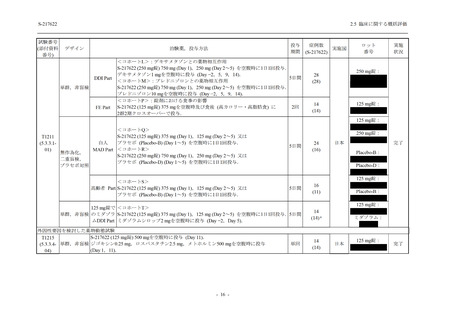
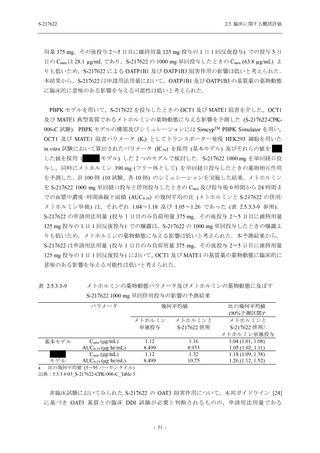
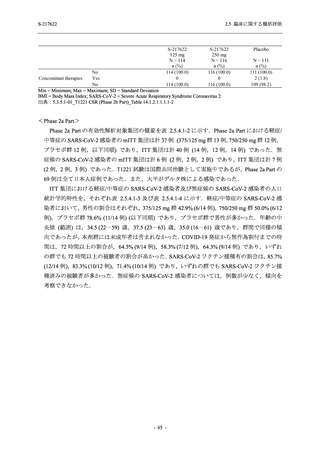
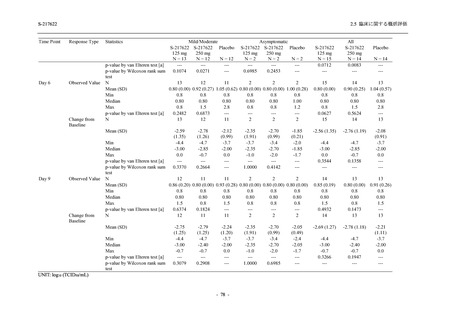
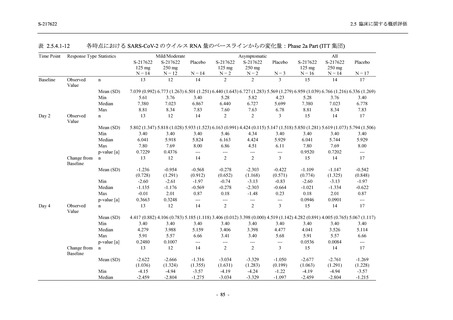
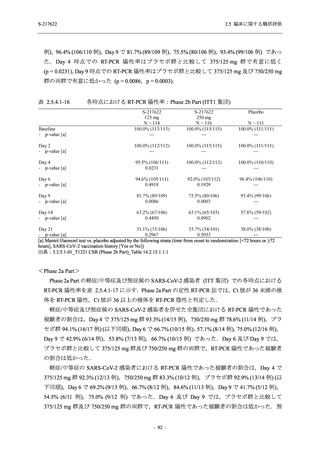
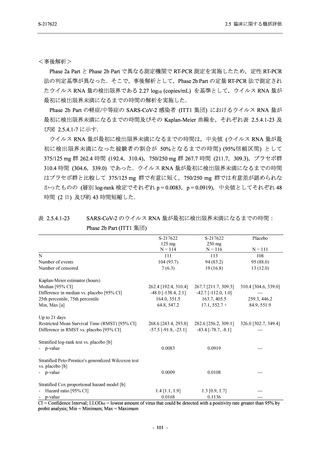
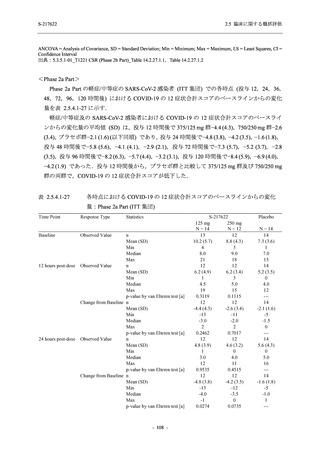
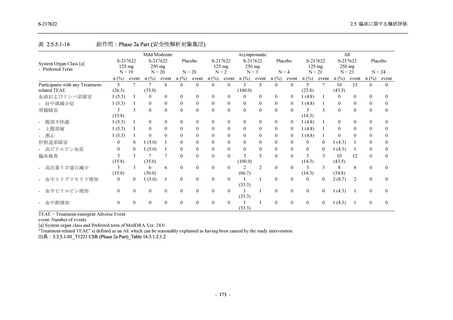
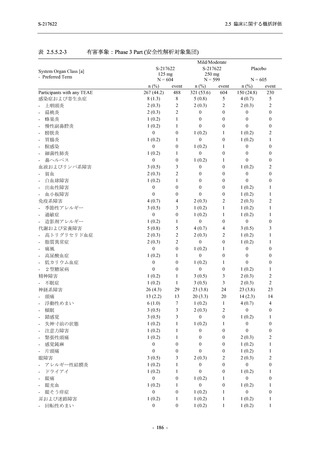
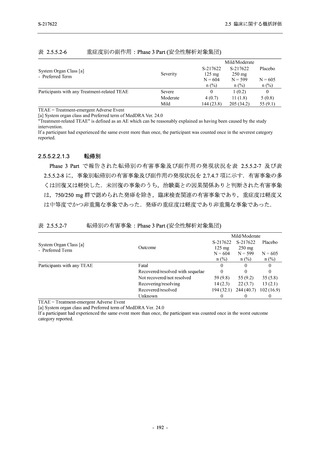
表 2.5.5.2-5
重症度別の有害事象:Phase 3 Part (安全性解析対象集団)
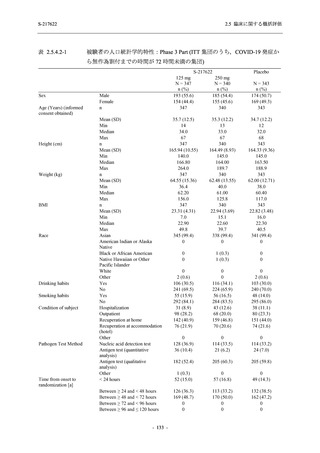
System Organ Class [a]
- Preferred Term
Participants with any TEAE
Severity
Severe
Moderate
Mild
S-217622
125 mg
N = 604
n (%)
1 (0.2)
13 (2.2)
253 (41.9)
Mild/Moderate
S-217622
Placebo
250 mg
N = 599
N = 605
n (%)
n (%)
1 (0.2)
2 (0.3)
18 (3.0)
13 (2.1)
302 (50.4)
135 (22.3)
TEAE = Treatment-emergent Adverse Event
[a] System organ class and Preferred term of MedDRA Ver. 24.0
If a participant had experienced the same event more than once, the participant was counted once in the severest category
reported.
- 191 -