【資料No.1】2.5_臨床に関する概括資料 (127 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
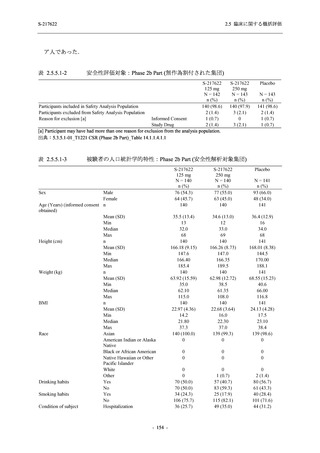
2.5 臨床に関する概括評価
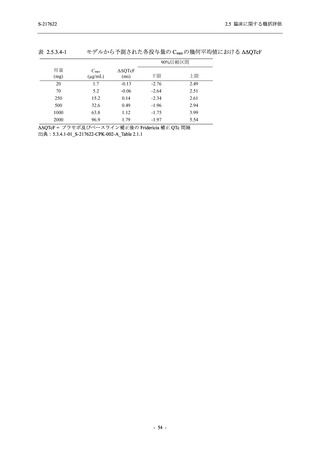
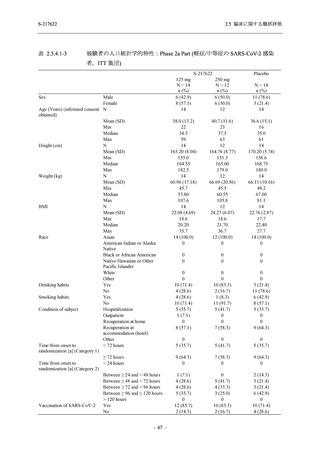
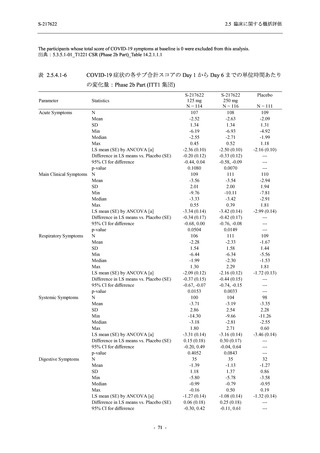
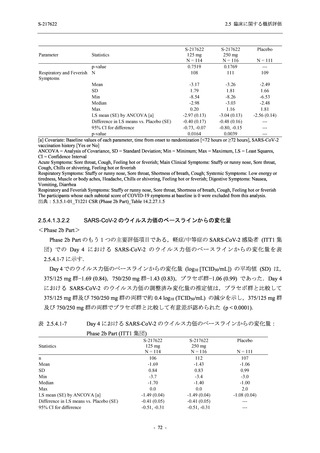
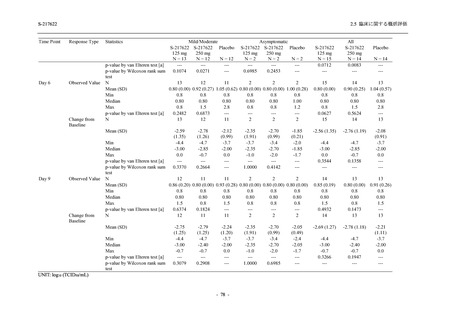
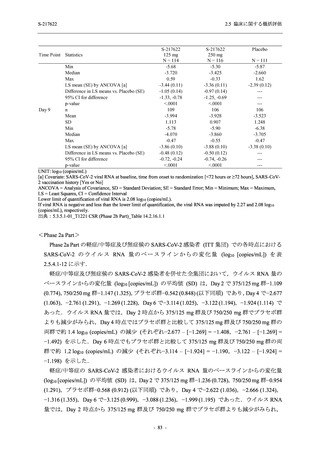
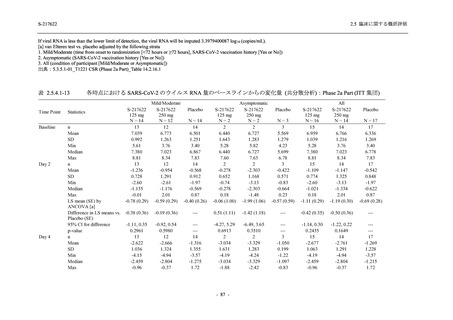
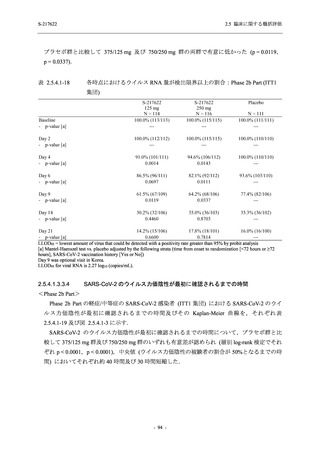
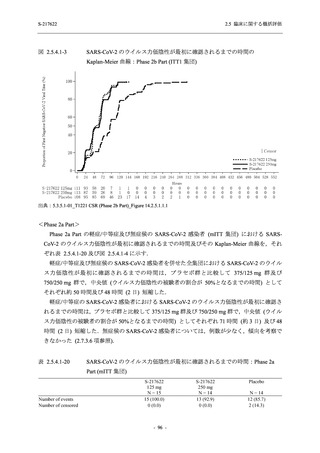
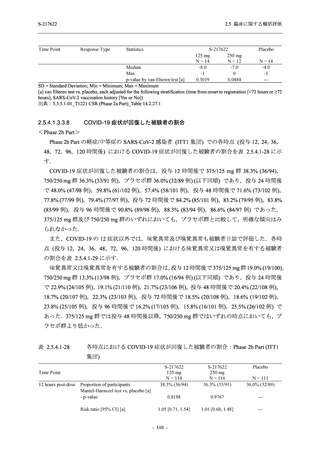
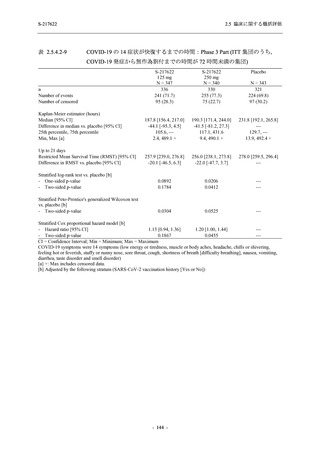
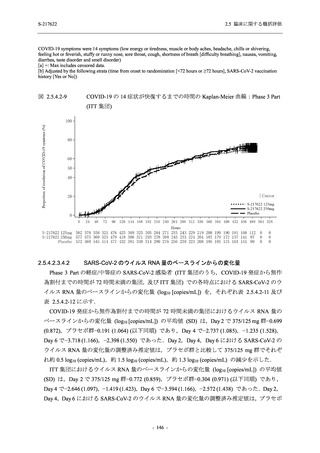
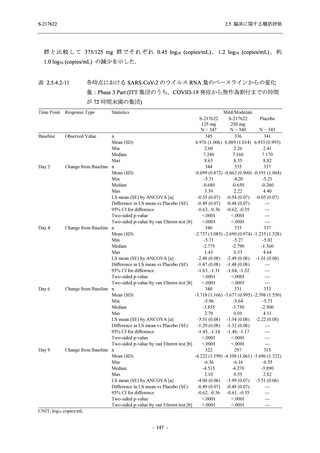
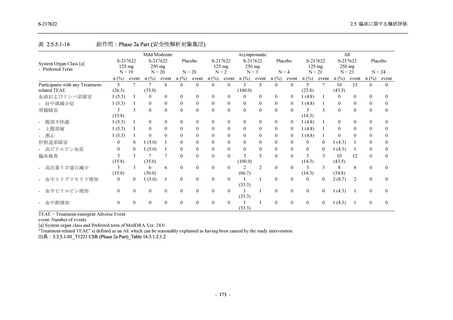
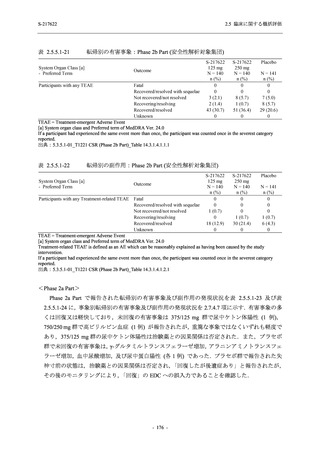
Phase 3 Part の主要な副次評価項目であるウイルス力価陰性が最初に確認されるまでの時間
(②) に対する主解析として,mITT 集団のうち,COVID-19 発症から無作為割付までの時間が 72
時間未満の集団を対象に,SARS-CoV-2 ワクチン接種の有無を層とする層別 log-rank 検定を用い
て,
片側有意水準 0.025 でウイルス力価陰性が最初に確認されるまでの時間について 375/125 mg
群とプラセボ群の間で比較を行う.主要な副次解析として,mITT 集団を対象に同様の解析を実
施する.このとき,SARS-CoV-2 ワクチン接種の有無に加えて,COVID-19 発症から無作為割付
までの時間 (72 時間未満,72 時間以上) も層に含める.
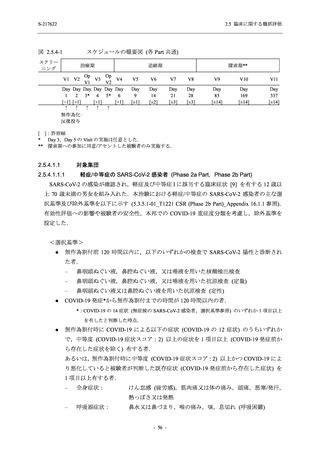
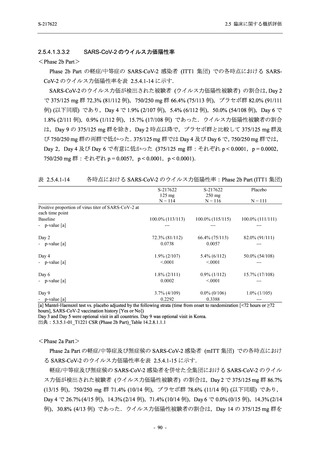
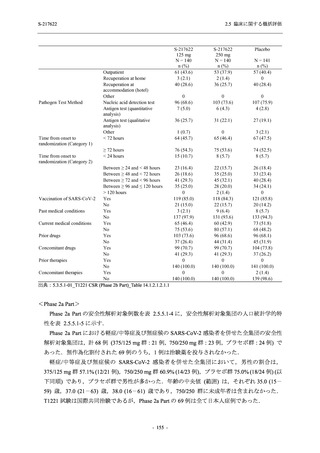
Phase 3 Part の主要評価項目及び主要な副次評価項目①②に対するその他の解析手法について
は T1221 試験治験実施計画書第 10 版に示す.
Phase 3 Part において,これらの評価項目について,375/125 mg 群とプラセボ群との比較に対
して固定順序法に基づく第 1 種の過誤率の制御を行った.多重性調整を行う比較は以下の手順
とした.
1.
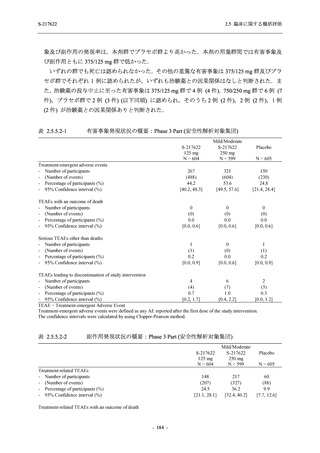
主要評価項目の主解析:ITT 集団のうち,COVID-19 発症から無作為割付までの時間が 72
時間未満の集団を対象に,有意水準を片側 0.025 とし,375/125 mg 群とプラセボ群の間
で COVID-19 の 5 症状が快復するまでの時間を比較.
2.
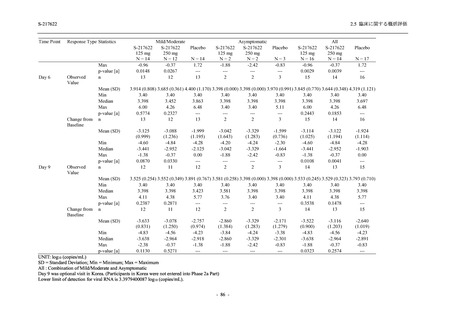
主要な副次評価項目①の主解析:1. の 375/125 mg 群とプラセボ群の比較で有意な差が検
出された場合のみ,片側有意水準 0.025 の下,ITT 集団のうち,COVID-19 発症から無作
為割付までの時間が 72 時間未満の集団を対象に,375/125 mg 群とプラセボ群の間で Day 4
におけるウイルス RNA 量のベースラインからの変化量を比較.
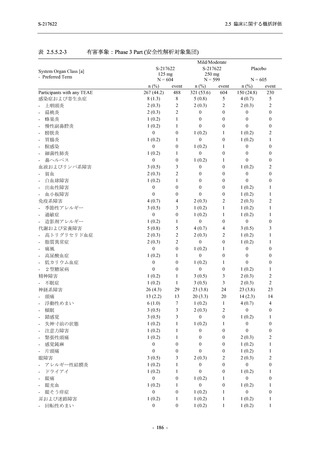
3.
主要な副次評価項目②の主解析:2. の 375/125 mg 群とプラセボ群の比較で有意な差が検
出された場合のみ,片側有意水準 0.025 の下,mITT 集団のうち,COVID-19 発症から無
作為割付までの時間が 72 時間未満の集団を対象に,375/125 mg 群とプラセボ群の間でウ
イルス力価陰性が最初に確認されるまでの時間を比較.
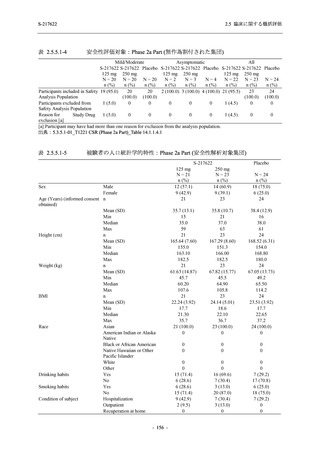
4.
主要評価項目の主要な副次解析:3. の 375/125 mg 群とプラセボ群の比較で有意な差が検
出された場合のみ,片側有意水準 0.025 の下,ITT 集団を対象に,375/125 mg 群とプラセ
ボ群の間で COVID-19 の 5 症状が快復するまでの時間を比較.
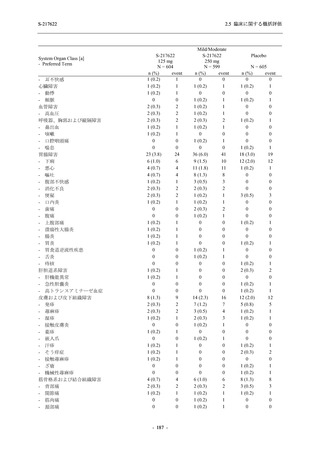
5.
主要な副次評価項目①の主要な副次解析:4. の 375/125 mg 群とプラセボ群の比較で有意
な差が検出された場合のみ,片側有意水準 0.025 の下,ITT 集団を対象に,375/125 mg 群
とプラセボ群の間で Day 4 におけるウイルス RNA 量のベースラインからの変化量を比
較.
6.
主要な副次評価項目②の主要な副次解析:5. の 375/125 mg 群とプラセボ群の比較で有意
な差が検出された場合のみ,片側有意水準 0.025 の下,mITT 集団を対象に,375/125 mg
群とプラセボ群の間でウイルス力価陰性が最初に確認されるまでの時間を比較.
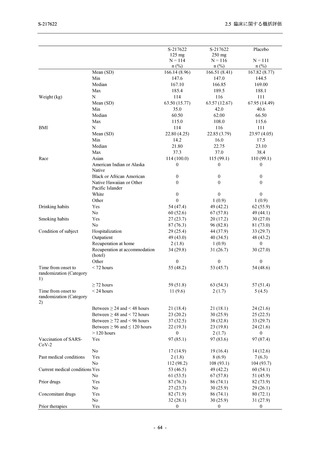
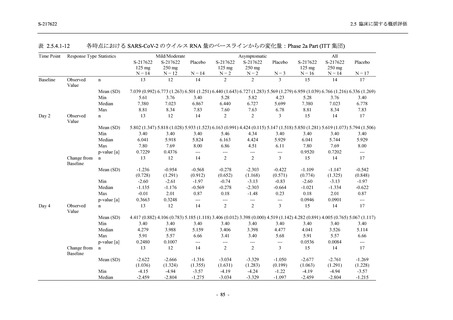
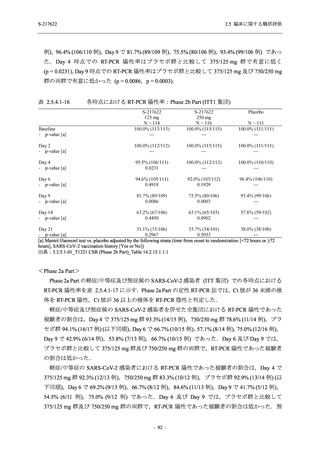
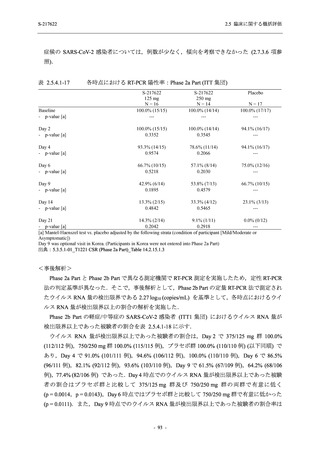
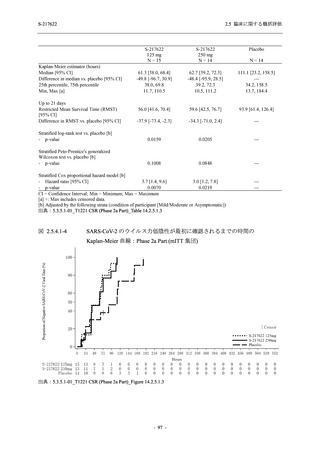
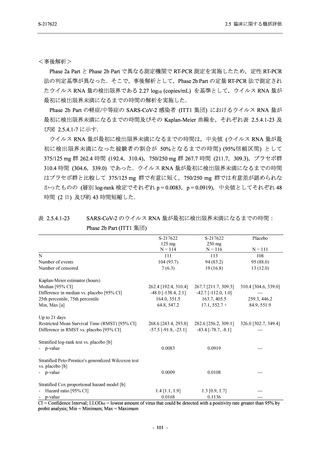
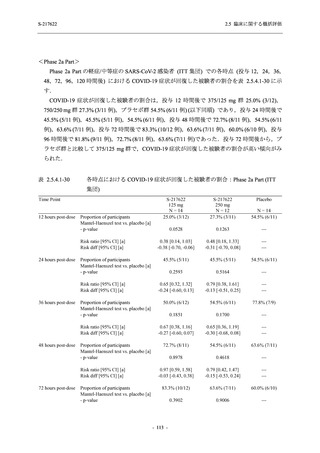
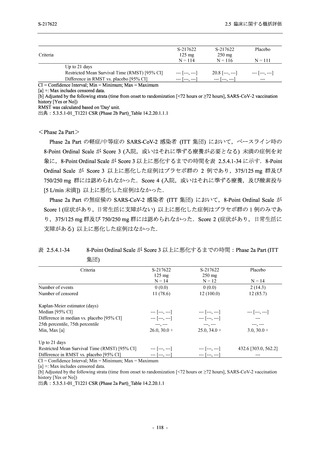
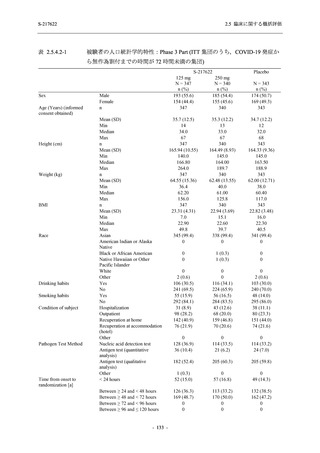
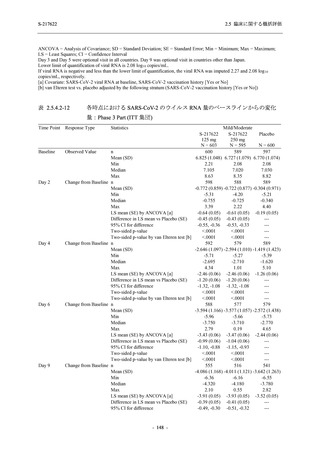
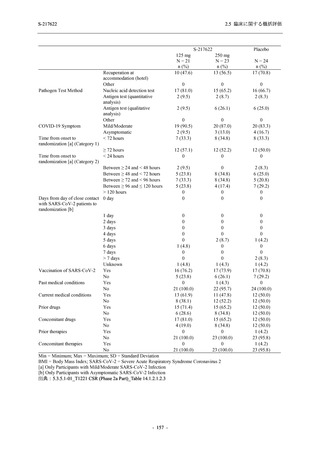
Phase 3 Part の副次評価項目として,COVID-19 の 12 症状が快復するまでの時間を評価した.
本評価項目に対して,COVID-19 の 5 症状が快復するまでの時間と同様の解析を行った.
- 127 -