【資料No.1】2.5_臨床に関する概括資料 (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.5 臨床に関する概括評価
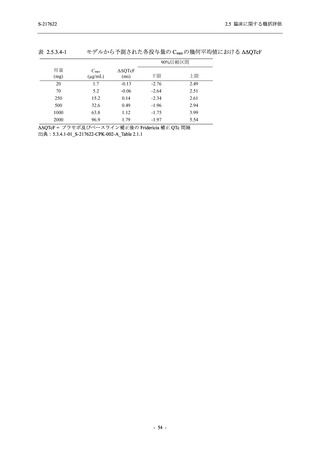
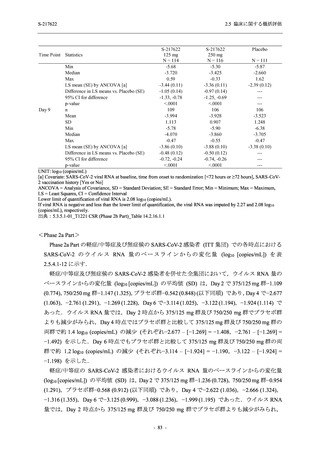
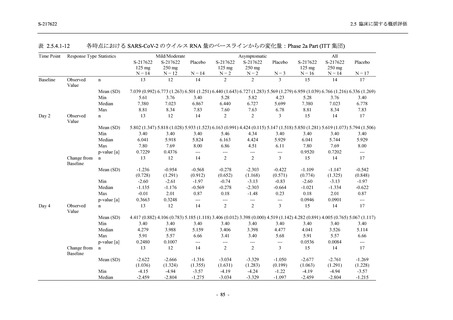
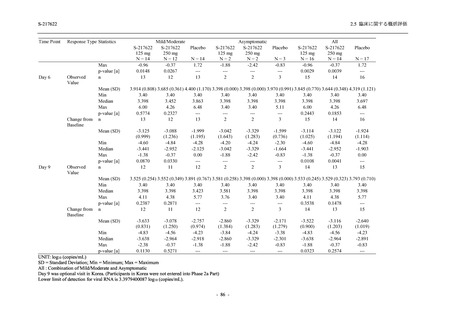
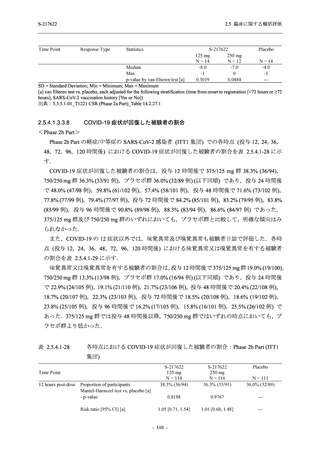
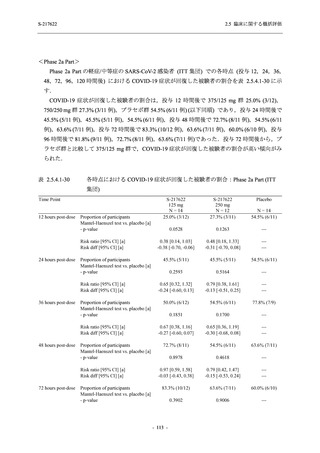
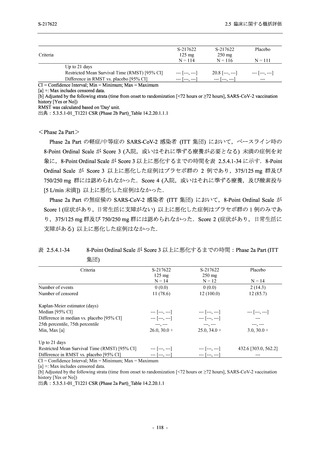
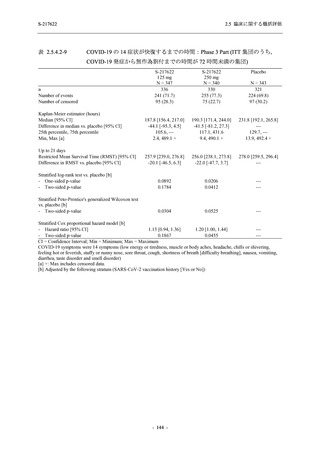
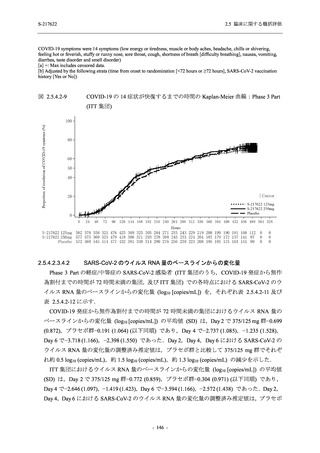
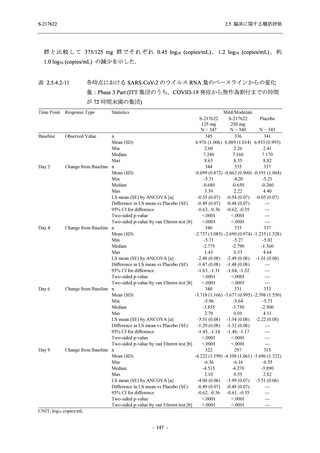
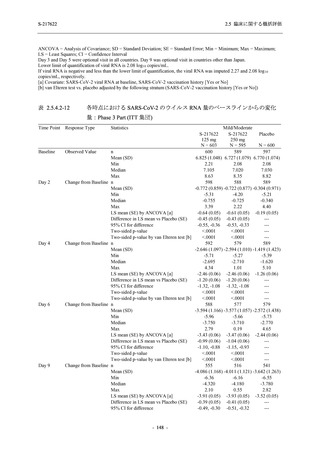
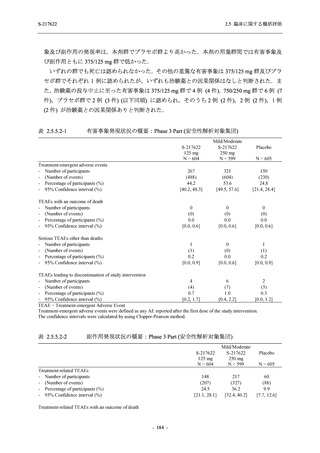
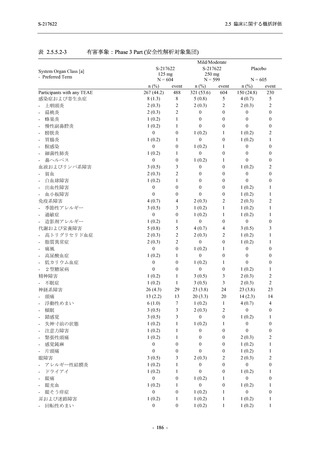
成人における安全性及び忍容性を確認した (5.3.3.1-01 参照).その後,2021 年 9 月から
SARS-CoV-2 感染者対象第 2/3 相試験 (以下,T1221 試験) を開始した.T1221 試験は無症候か
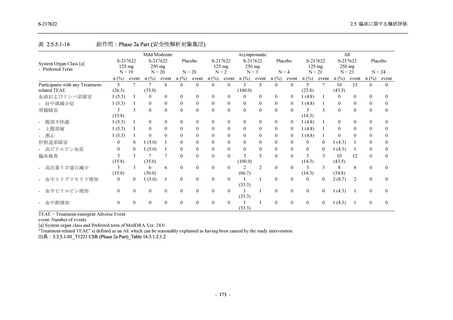
ら中等症の感染者を対象とした第 2/3 相試験として計画し,その内の Phase 2a Part では本剤の
抗ウイルス効果を探索的に評価すること,Phase 2b Part では本剤の早期の臨床症状改善効果及
び抗ウイルス効果を確認すること,Phase 3 Part 及び Phase 2b/3 Part では本剤の有効性を検証す
ることを主目的とした.また,健康成人対象第 1 相薬物相互作用試験 (以下,T1215 試験) では,
ジゴキシン (P 糖タンパク質 [P-gp] 基質),ロスバスタチン (乳がん耐性タンパク質 [BCRP],
有機アニオントランスポーターポリペプチド [OATP] 1B1 及び OATP1B3 基質) 及びメトホルミ
ン (有機カチオントランスポーター [OCT] 1 及び multidrug and toxin extrusion [MATE] 1 基質)
との薬物相互作用を評価した.
本資料は,第 1 相試験である T1211 試験のコホート A からコホート S,T1215 試験,並びに
第 2/3 相試験である T1221 試験 Phase 2b Part 及び Phase 2a Part の結果に基づいて作成するもの
である.
臨床試験の進捗に伴い,追記する.
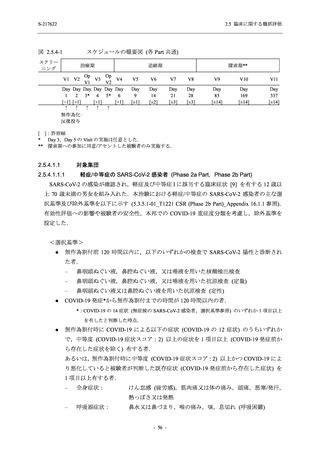
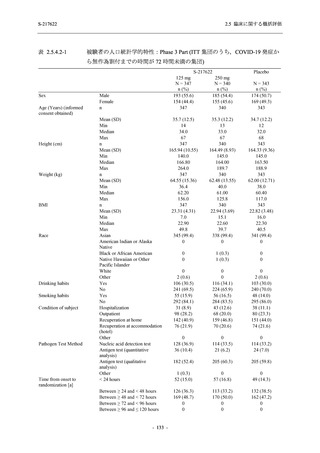
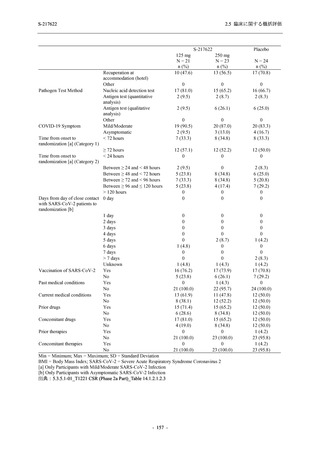
本剤の申請パッケージとして,第 1 相試験 2 試験が完了し,第 2/3 相試験が実施中である (表
2.5.1.4-1 参照).
健康成人対象第 1 相試験 (T1211 試験) 及び第 1 相薬物相互作用試験 (T1215 試験),SARSCoV-2 感染者対象第 2/3 相試験 (T1221 試験) Phase 2a Part 及び Phase 2b Part の結果に基づき,
2022 年 2 月 25 日に本剤の製造承認販売申請を行ったが,同年 7 月 20 日の薬事分科会・医薬品
第二部会 (合同開催) において,T1221 試験 Phase 3 Part 等の結果をもって継続審議と判断され
た.今回,Phase 3 Part の主要な結果を入手し,追加評価を行った.
なお,本剤の開発及び臨床試験は,医薬品医療機器総合機構 (PMDA) 等と相談及び協議の上,
計画実施した.
特に,本剤の有効性を検証することを目的とした T1221 試験 Phase 3 Part の計画変更について
は,医学専門家や厚生労働省,PMDA,米国食品医薬品局等の規制当局との協議を経て,その科
学的かつ医学的妥当性を踏まえた上で実施した.主な変更内容及びその妥当性は 2.5.4.2.2.3 項
に示す.
2.5.1.4
臨床試験実施の基準の遵守
本剤の全ての臨床試験は,医薬品の臨床試験実施基準 (GCP) ガイドライン,ヘルシンキ宣言
に記載された全ての倫理的原則,並びに研究が実施される国の法令に従って実施している.
- 14 -