【資料No.1】2.5_臨床に関する概括資料 (159 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
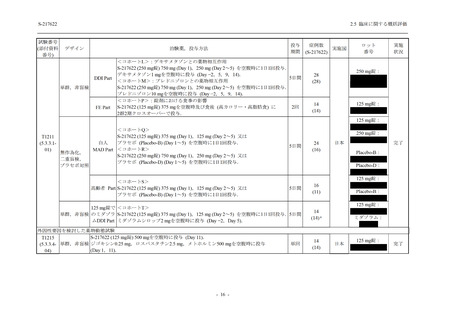
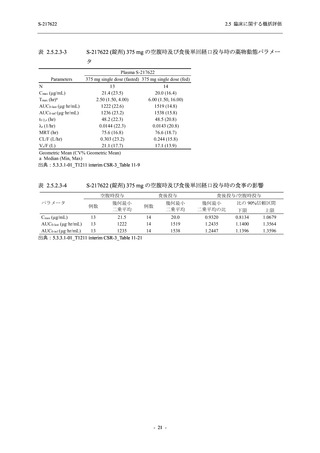
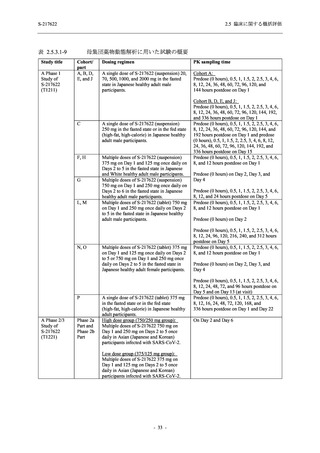
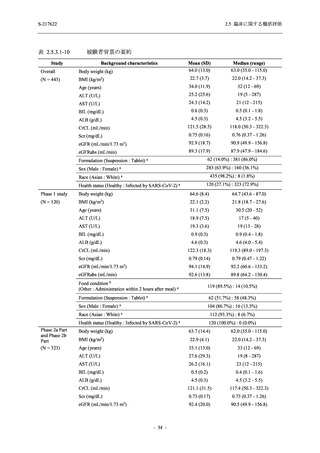
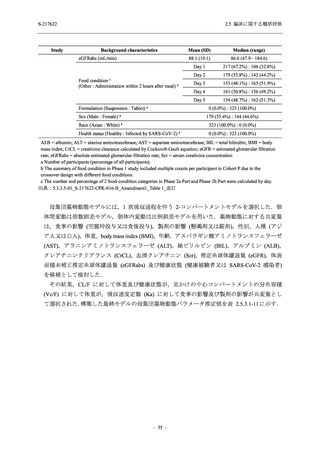
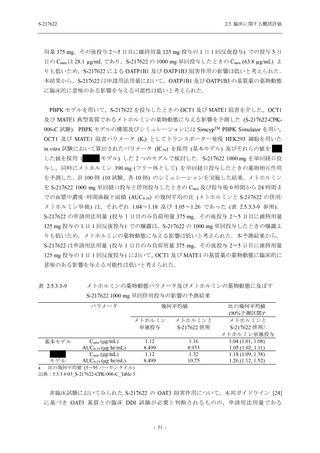
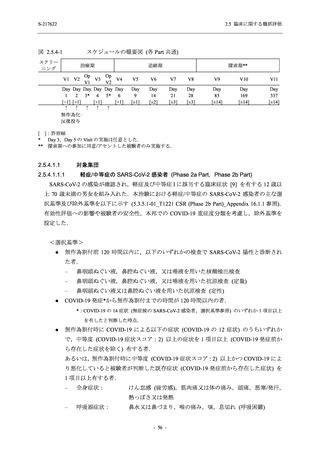
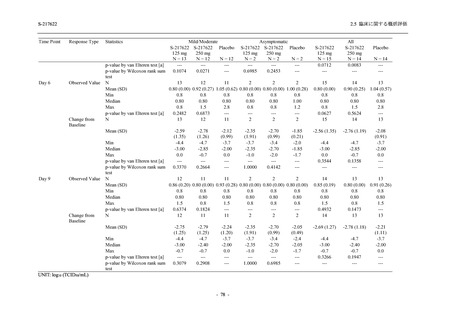
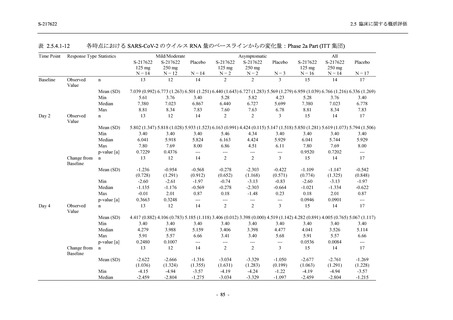
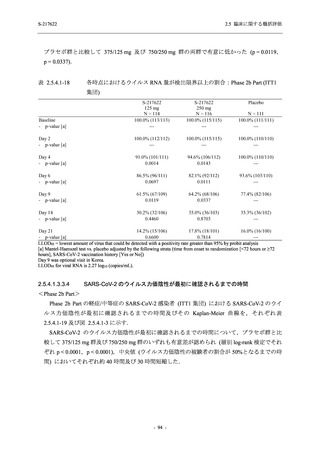
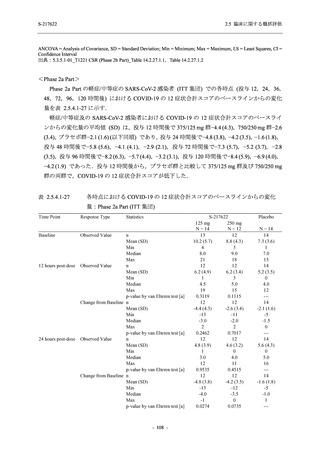
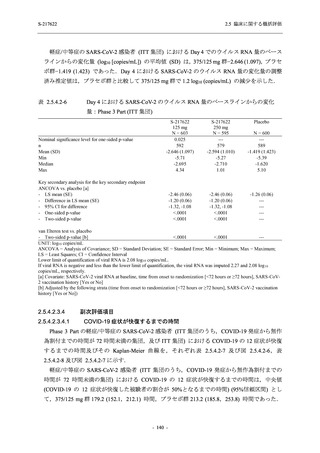
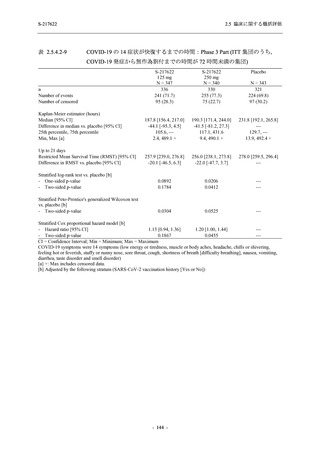
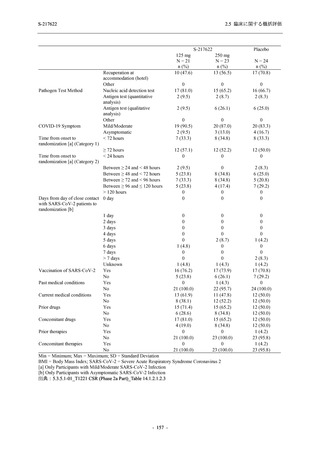
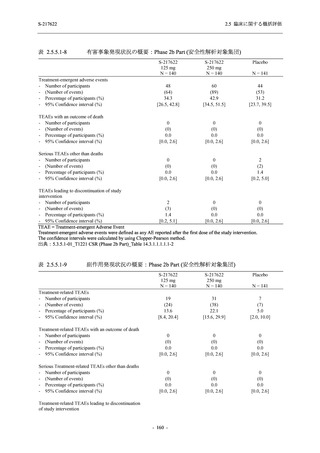
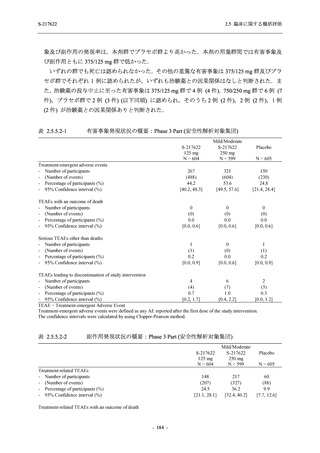
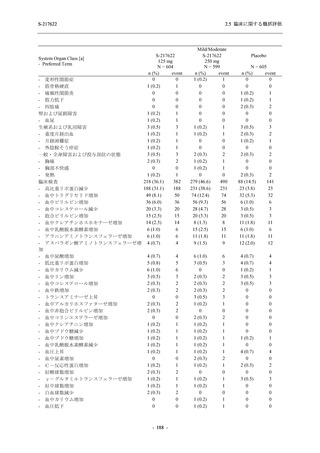
表 2.5.5.1-7
2.5 臨床に関する概括評価
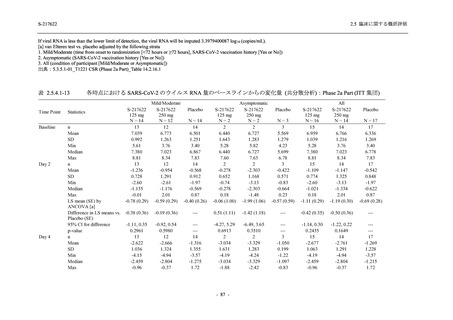
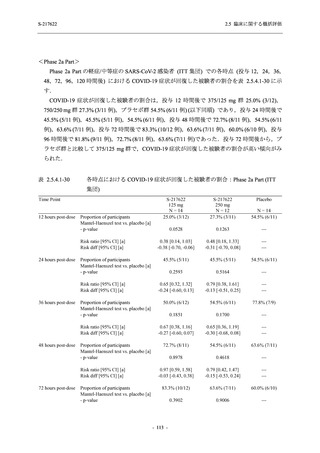
開鍵時の副作用発現状況の概要:Phase 2b Part (安全性解析対象集団)
S-217622
125 mg
N = 140
S-217622
250 mg
N = 140
Placebo
N = 141
Treatment-related TEAEs
- Number of participants
- (Number of events)
- Percentage of participants (%)
- 95% Confidence interval (%)
13
(15)
9.3
[5.0, 15.4]
26
(32)
18.6
[12.5, 26.0]
7
(7)
5.0
[2.0, 10.0]
Treatment-related TEAEs with an outcome of death
- Number of participants
- (Number of events)
- Percentage of participants (%)
- 95% Confidence interval (%)
0
(0)
0.0
[0.0, 2.6]
0
(0)
0.0
[0.0, 2.6]
0
(0)
0.0
[0.0, 2.6]
Serious Treatment-related TEAEs other than deaths
- Number of participants
- (Number of events)
- Percentage of participants (%)
- 95% Confidence interval (%)
0
(0)
0.0
[0.0, 2.6]
0
(0)
0.0
[0.0, 2.6]
0
(0)
0.0
[0.0, 2.6]
Treatment-related TEAEs leading to discontinuation
of study intervention
- Number of participants
2
0
0
- (Number of events)
(3)
(0)
(0)
- Percentage of participants (%)
1.4
0.0
0.0
- 95% Confidence interval (%)
[0.2, 5.1]
[0.0, 2.6]
[0.0, 2.6]
TEAE = Treatment-emergent Adverse Event
'Treatment-related TEAE' is defined as an AE which can be reasonably explained as having been caused by the study
intervention.
The confidence intervals were calculated by using Clopper-Pearson method.
出典:5.3.5.1-01_T1221 CSR (Phase 2b Part)_Table 14.3.1.1.1.2.1-1
また,開鍵後に入手した情報を含む有害事象及び副作用の発現状況の概要を,それぞれ表
2.5.5.1-8 及び表 2.5.5.1-9 に示す.
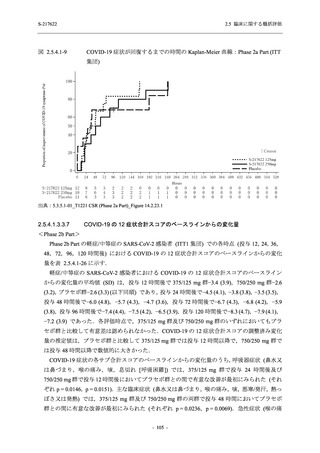
Phase 2b Part の軽症/中等症の SARS-CoV-2 感染者における有害事象の発現率は,375/125 mg
群 34.3% (48/140 例),750/250 mg 群 42.9% (60/140 例),プラセボ群 31.2% (44/141 例) (以下同順)
であり,開鍵以降,375/125 mg 群では 11 例,750/250 mg 群では 12 例,プラセボ群では 10 例に
新たに有害事象が認められた.また,副作用の発現率は 13.6% (19/140 例),22.1% (31/140 例),
5.0% (7/141 例) であり,開鍵以降,375/125 mg 群では 6 例,750/250 mg 群では 5 例に新たに副
作用が認められ,プラセボ群では新たな副作用は認められなかった.開鍵以降,新たに死亡,
その他の重篤な有害事象は,いずれの群でも認められなかった.
なお,Day 14 までの結果は,2.7.4.7 項に示す.
- 159 -