【資料No.1】2.5_臨床に関する概括資料 (186 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
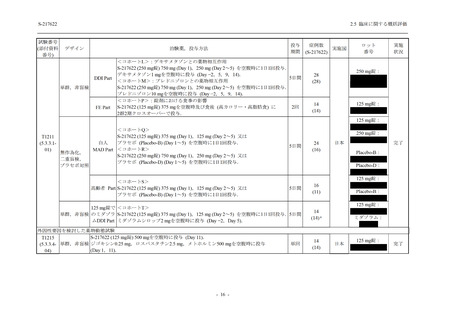
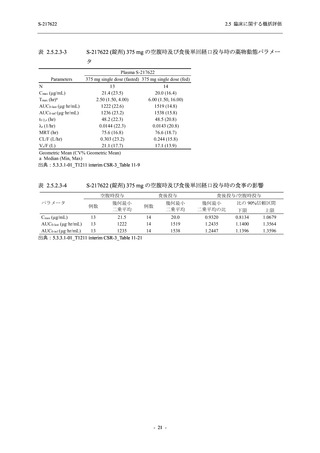
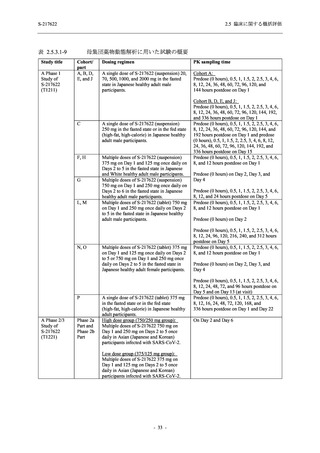
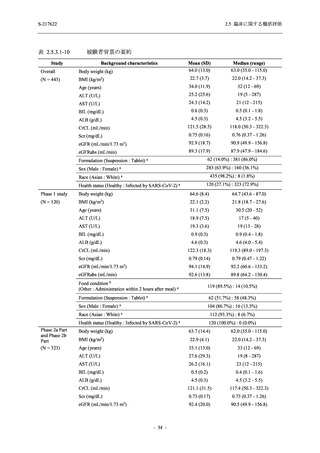
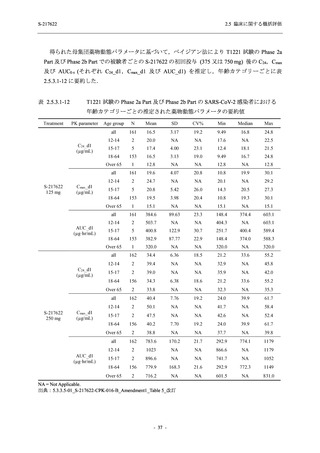
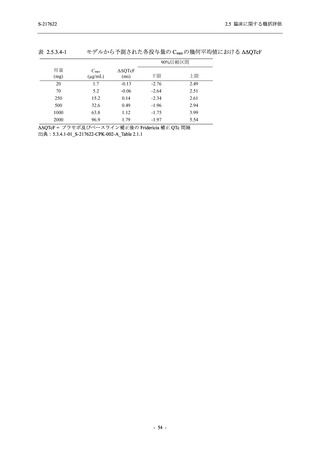
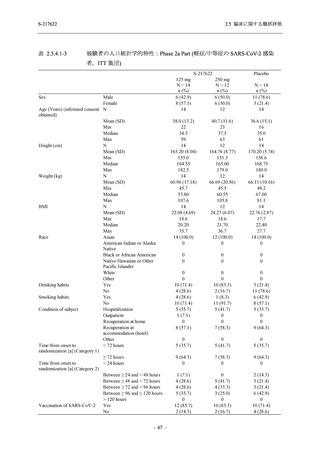
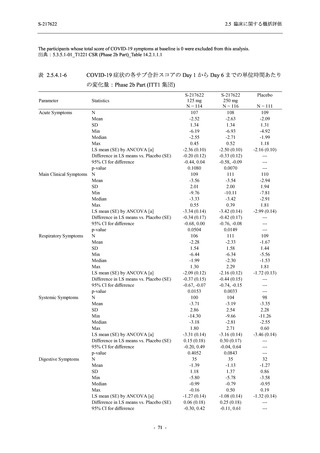
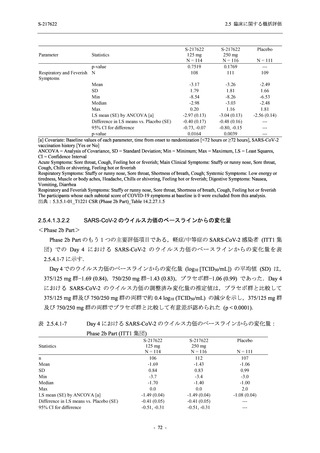
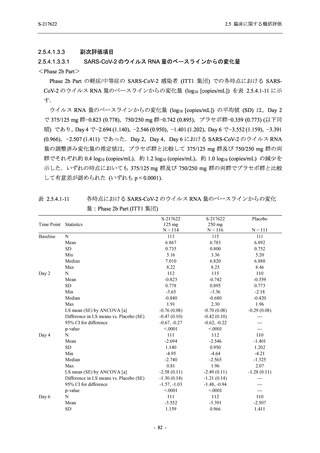
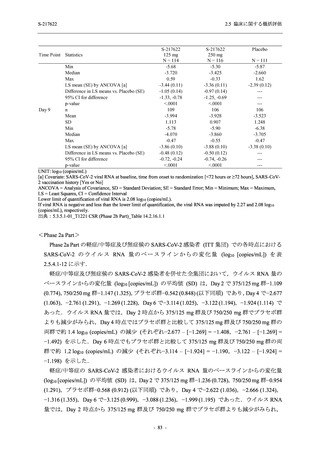
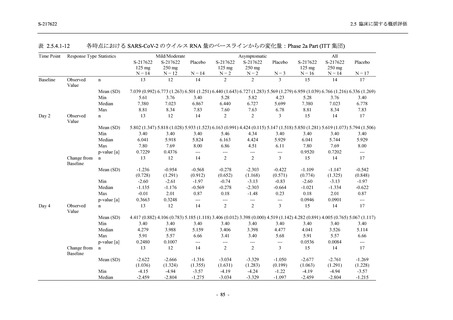
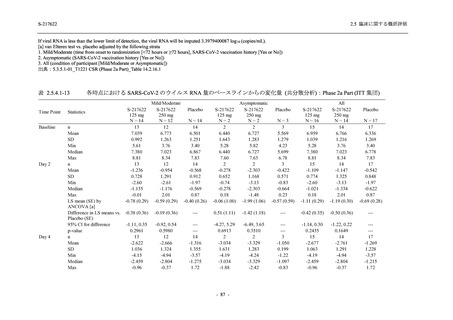
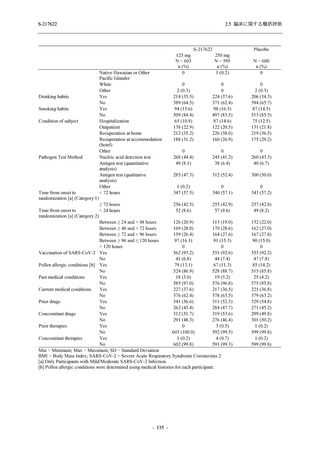
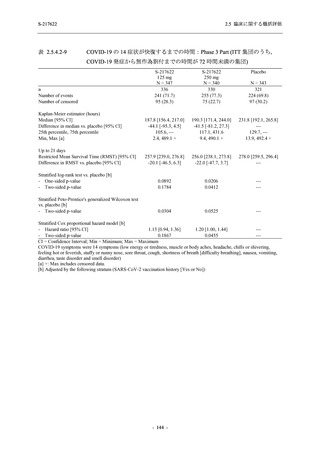
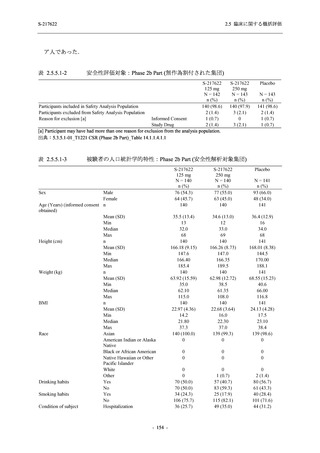
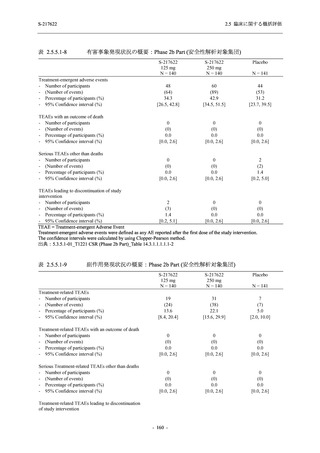
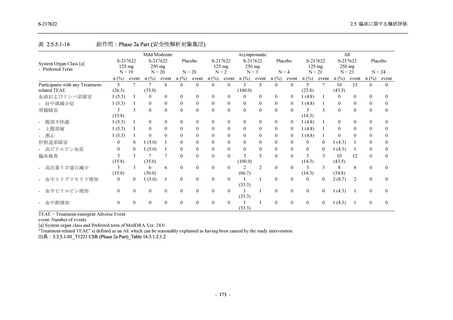
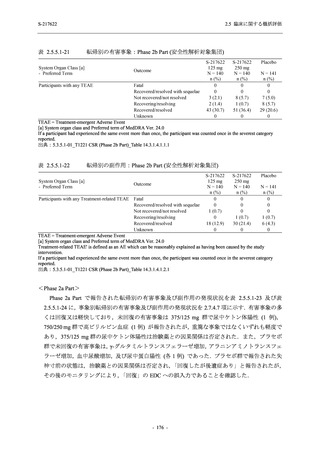
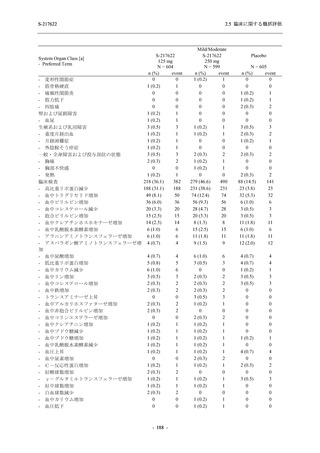
表 2.5.5.2-3
2.5 臨床に関する概括評価
有害事象:Phase 3 Part (安全性解析対象集団)
System Organ Class [a]
- Preferred Term
Participants with any TEAE
感染症および寄生虫症
- 上咽頭炎
- 扁桃炎
- 蜂巣炎
- 慢性副鼻腔炎
- 膀胱炎
- 胃腸炎
- 腟感染
- 細菌性肺炎
- 鼻ヘルペス
血液およびリンパ系障害
- 貧血
- 白血球障害
- 出血性障害
- 血小板障害
免疫系障害
- 季節性アレルギー
- 過敏症
- 造影剤アレルギー
代謝および栄養障害
- 高トリグリセリド血症
- 脂質異常症
- 痛風
- 高尿酸血症
- 低カリウム血症
- 2型糖尿病
精神障害
- 不眠症
神経系障害
- 頭痛
- 浮動性めまい
- 傾眠
- 錯感覚
- 失神寸前の状態
- 注意力障害
- 緊張性頭痛
- 感覚鈍麻
- 片頭痛
眼障害
- アレルギー性結膜炎
- ドライアイ
- 眼痛
- 眼充血
- 眼そう痒症
耳および迷路障害
- 回転性めまい
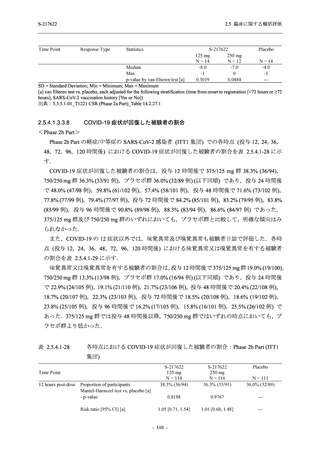
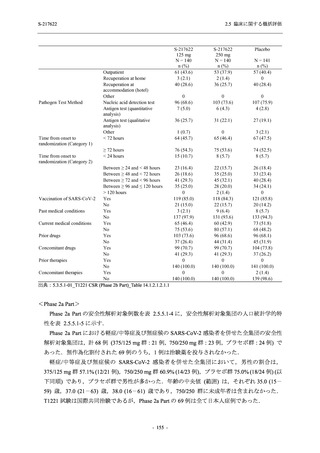
S-217622
125 mg
N = 604
n (%)
event
267 (44.2)
488
8 (1.3)
8
2 (0.3)
2
2 (0.3)
2
1 (0.2)
1
1 (0.2)
1
0
0
1 (0.2)
1
0
0
1 (0.2)
1
0
0
3 (0.5)
3
2 (0.3)
2
1 (0.2)
1
0
0
0
0
4 (0.7)
4
3 (0.5)
3
0
0
1 (0.2)
1
5 (0.8)
5
2 (0.3)
2
2 (0.3)
2
0
0
1 (0.2)
1
0
0
0
0
1 (0.2)
1
1 (0.2)
1
26 (4.3)
29
13 (2.2)
13
6 (1.0)
7
3 (0.5)
3
3 (0.5)
3
1 (0.2)
1
1 (0.2)
1
1 (0.2)
1
0
0
0
0
3 (0.5)
3
1 (0.2)
1
1 (0.2)
1
0
0
1 (0.2)
1
0
0
1 (0.2)
1
0
0
- 186 -
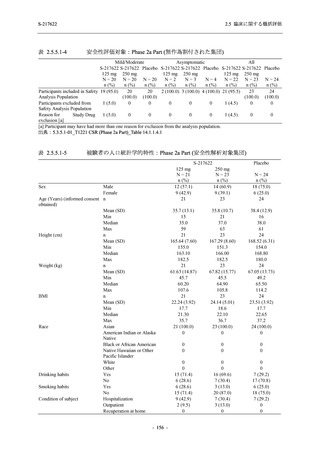
Mild/Moderate
S-217622
250 mg
N = 599
n (%)
event
321 (53.6)
604
5 (0.8)
5
2 (0.3)
2
0
0
0
0
0
0
1 (0.2)
1
0
0
1 (0.2)
1
0
0
1 (0.2)
1
0
0
0
0
0
0
0
0
0
0
2 (0.3)
2
1 (0.2)
1
1 (0.2)
1
0
0
4 (0.7)
4
2 (0.3)
2
0
0
1 (0.2)
1
0
0
1 (0.2)
1
0
0
3 (0.5)
3
3 (0.5)
3
23 (3.8)
24
20 (3.3)
20
1 (0.2)
1
2 (0.3)
2
0
0
1 (0.2)
1
0
0
0
0
0
0
0
0
2 (0.3)
2
0
0
0
0
1 (0.2)
1
0
0
1 (0.2)
1
1 (0.2)
1
1 (0.2)
1
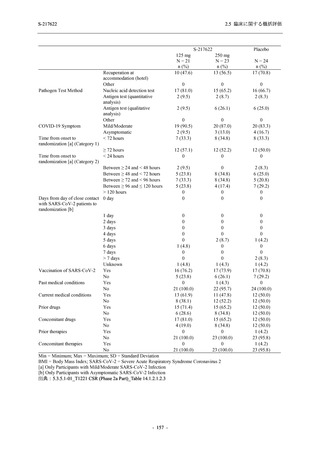
Placebo
N = 605
n (%)
event
150 (24.8)
230
4 (0.7)
5
2 (0.3)
2
0
0
0
0
0
0
1 (0.2)
2
1 (0.2)
1
0
0
0
0
0
0
1 (0.2)
2
0
0
0
0
1 (0.2)
1
1 (0.2)
1
2 (0.3)
2
1 (0.2)
1
1 (0.2)
1
0
0
3 (0.5)
3
1 (0.2)
1
1 (0.2)
1
0
0
0
0
0
0
1 (0.2)
1
2 (0.3)
2
2 (0.3)
2
23 (3.8)
23
14 (2.3)
14
4 (0.7)
4
0
0
1 (0.2)
1
0
0
0
0
2 (0.3)
2
1 (0.2)
1
1 (0.2)
1
2 (0.3)
2
0
0
1 (0.2)
1
0
0
1 (0.2)
1
0
0
1 (0.2)
1
1 (0.2)
1