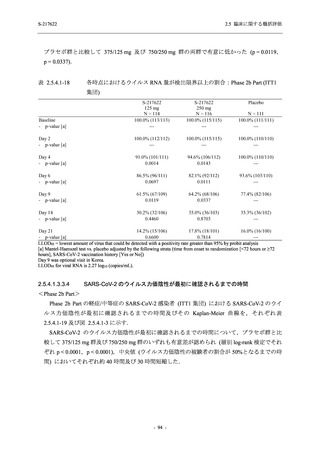
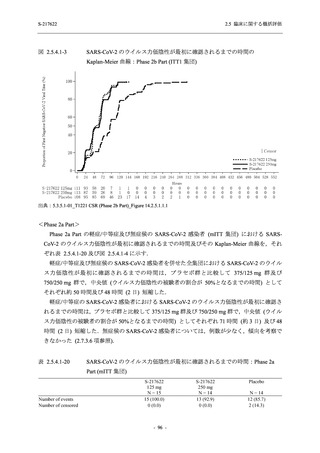
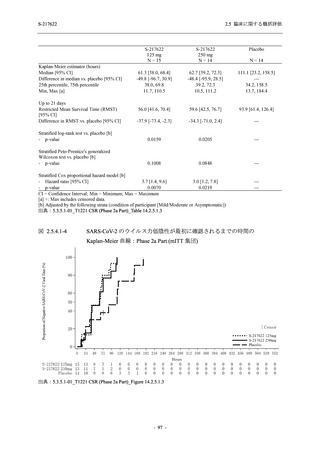
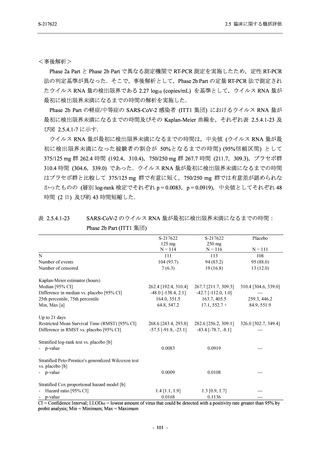
【資料No.1】2.5_臨床に関する概括資料 (152 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.5 臨床に関する概括評価
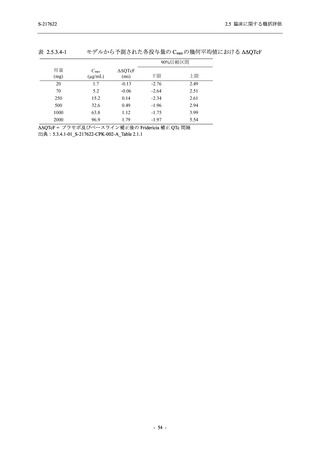
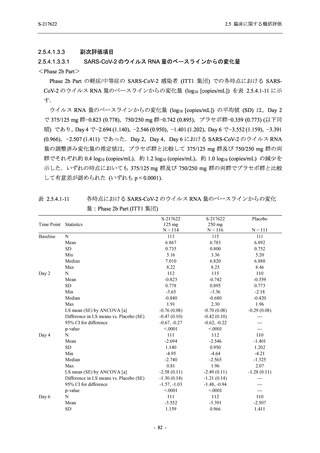
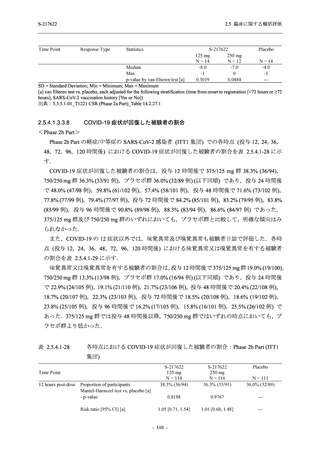
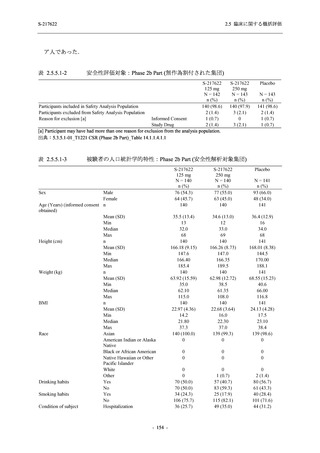
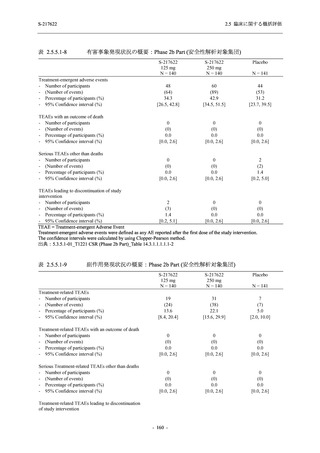
善効果を示すことを考慮すると,ウイルスがまだ十分増殖していない状態又は体内のウイルス
量が高い状態の感染後早期に抗ウイルス薬の投与を開始することが重要である.実際,
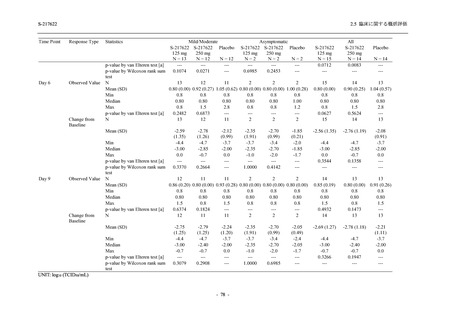
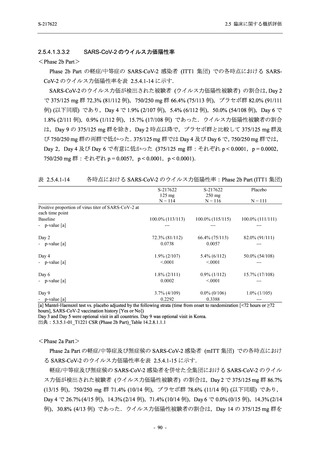
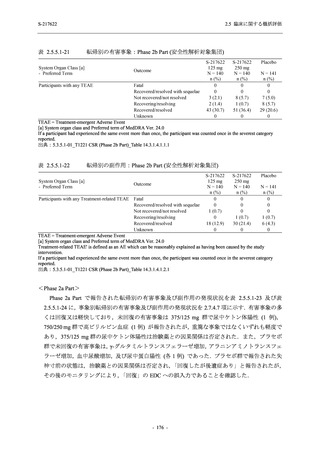
COVID-19 発症から無作為割付までの時間が 72 時間以上の集団を含む ITT 集団では,72 時間未
満の集団と比較してウイルス RNA 量のベースラインが低く (2.5.4.1.3.3.1 項参照),Day 4 にお
けるウイルス RNA 量のベースラインからの変化量のプラセボ群と 375/125 mg 群の差が小さ
かった (2.5.4.2.3.3.1 項参照).このことから,ITT 集団では,72 時間未満の集団と比較して,ベー
スライン時点でウイルス RNA 量が低く,その後速やかに低下した被験者が含まれ,主要評価項
目で評価対象とした 5 症状での罹病期間に基づく臨床症状改善効果の差も観察されにくくなっ
たため,本試験での評価対象集団では,中央値の数値として 10.6 時間の短縮になったと考えら
れる.
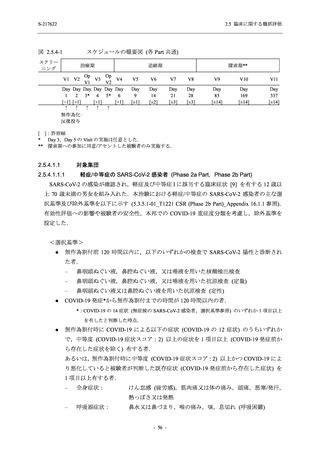
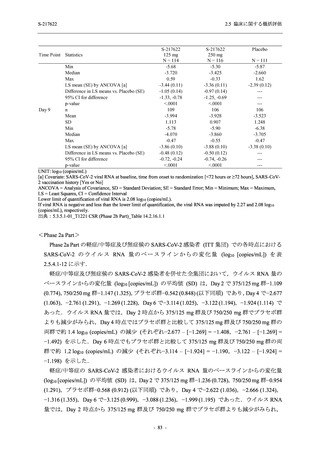
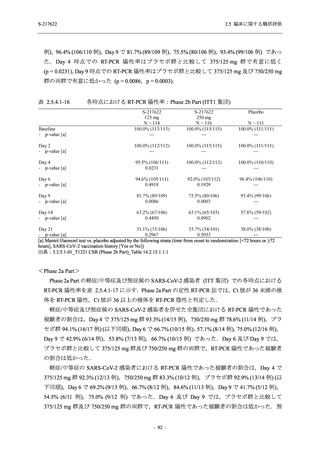
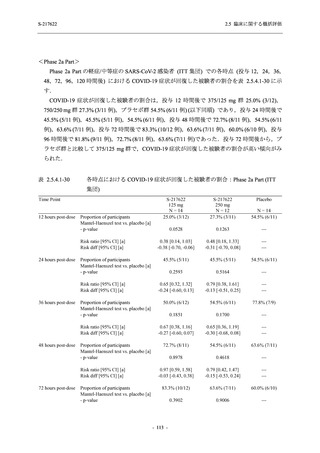
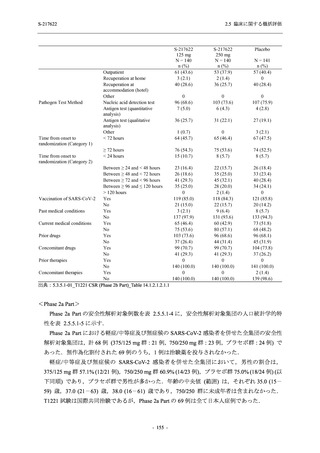
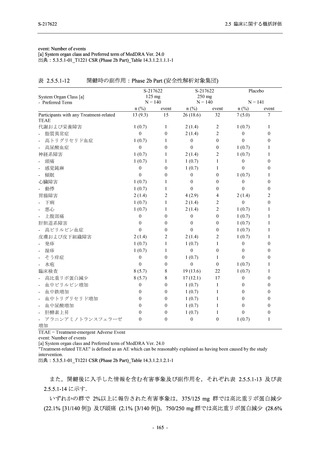
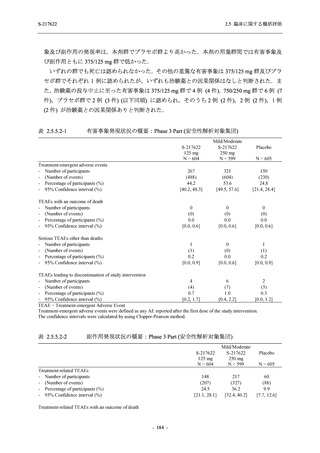
また,固定順序法の 3 番目は未入手で,さらに 4 番目も統計的に有意な差が認められなかっ
たため,5 番目である本解析も多重性調整された下での評価はできないものの,ITT 集団での
Day 4 でのウイルス RNA 量のベースラインからの変化量の調整済み推定値は,プラセボ群と比
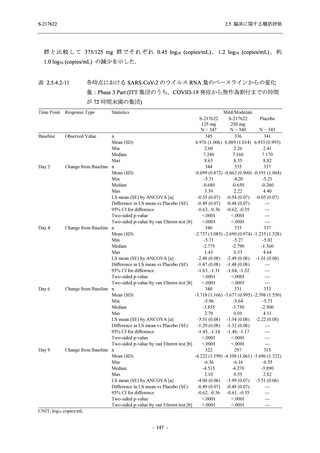
較して 375/125 mg 群で 1.2 log10 (copies/mL) の減少を示したことから (2.5.4.2.3.3.1 項参照),
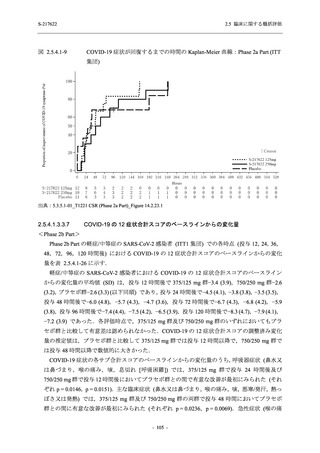
COVID-19 発症から 120 時間までの範囲では,本剤投与までの時間にかかわらず,Phase 2a Part
及び Phase 2b Part の結果と同様に,本剤の優れた抗ウイルス効果が示唆されたと考える.
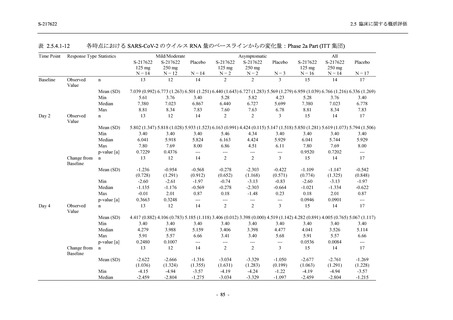
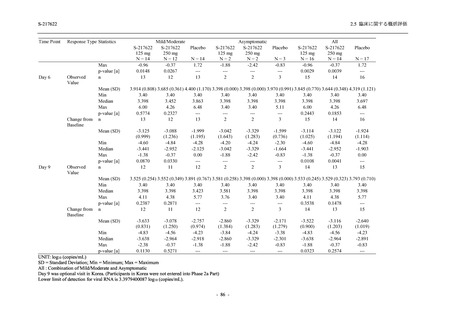
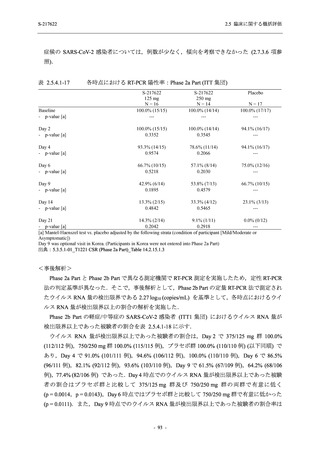
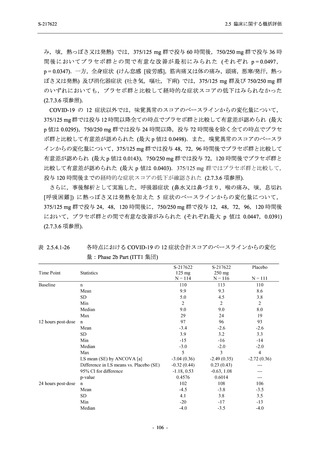
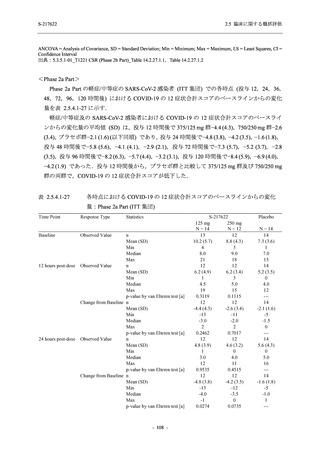
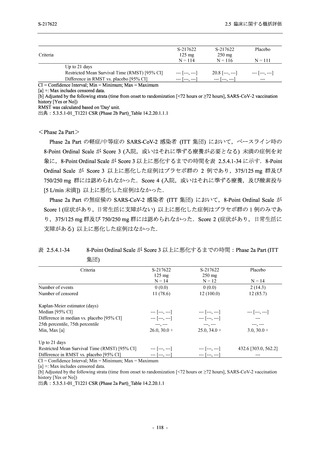
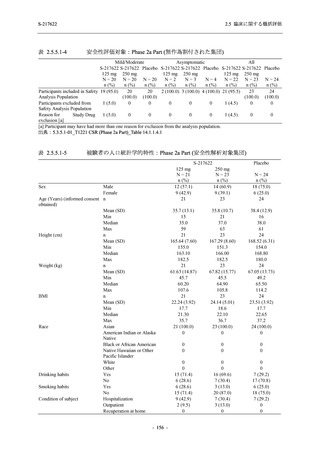
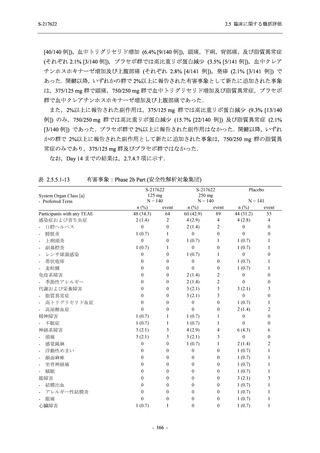
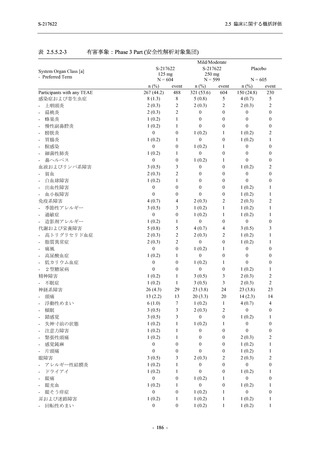
その他の副次評価項目である COVID-19 の 12 症状及び 14 症状が快復するまでの時間におい
て,COVID-19 発症から無作為割付までの時間が 72 時間未満の集団では,プラセボ群と比較し
て 375/125 mg 群で,それぞれ中央値として 34.0 時間 (約 1.5 日) の短縮傾向及び 44.1 時間 (約
2 日) の短縮が認められた (2.5.4.2.3.4.1 項参照).これらの結果,オミクロン株に特徴的な 5 症
状 (鼻水又は鼻づまり,喉の痛み,咳,熱っぽさ又は発熱,けん怠感 [疲労感]) に限らず
COVID-19 の幅広い症状においても類似の傾向を示し,本剤の臨床症状改善効果を支持してい
るものと考える.
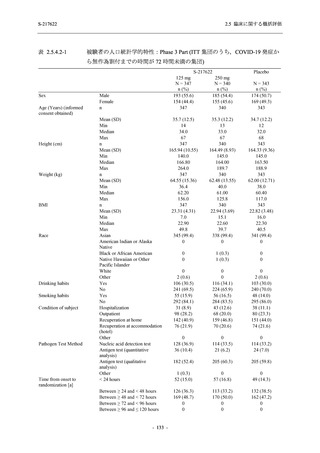
以上に示した通り,COVID-19 発症から無作為割付までの時間が 72 時間未満の集団で,臨床
症状改善効果及びウイルス RNA 量を基準とした抗ウイルス効果が検証され,ITT 集団でも,中
央値の数値として罹病期間の短縮及びウイルス RNA 量の減少が認められた.また,主要評価項
目の評価対象症状とした 5 症状に限らず,COVID-19 の 12 症状及び 14 症状を対象とした場合
でも類似の傾向を示したことから,本剤は COVID-19 の幅広い症状に有効であると考える.
- 152 -