提案書01(0001頁~0202頁)医療技術評価・再評価提案書 (181 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190899_00011.html |
| 出典情報 | 中央社会保険医療協議会 診療報酬調査専門組織・医療技術評価分科会(令和5年度第1回 11/20)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
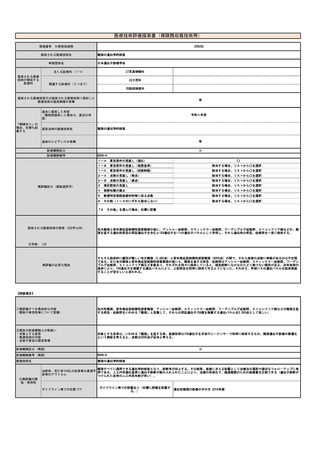
整理番号
提案される医療技術名
申請団体名
M000-2
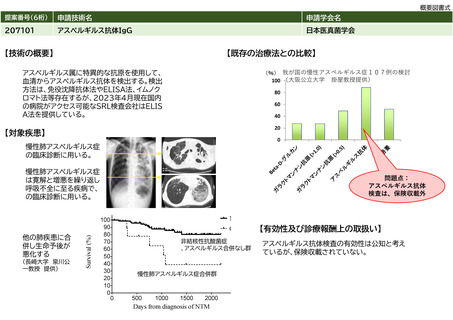
放射性同位元素内用療法管理料
215103
神経芽腫に対するもの
日本核医学会
※ 薬事承認されていない医薬品、医療機器又は体外診断用医薬品を使用した技術は、原則として医療技術評価分科会での評価の対象外である。承認見込みの場
合、令和5年(2023年)8月末日迄に承認取得が可能な場合のみ、評価の対象となることに留意すること。
※
※
※
※
医薬品、医療機器又は体外診断薬については、当該技術の核となるものについて必ず具体的な薬品名、製品名を記載すること。
該当する製品の添付文書を添付すること。
薬事承認上の内容等が不明な場合は、添付文書を確認するか、製造販売会社等に問い合わせること。
記載が不十分であると判断した場合は評価の対象外となるため、必要事項をもれなく記載すること。
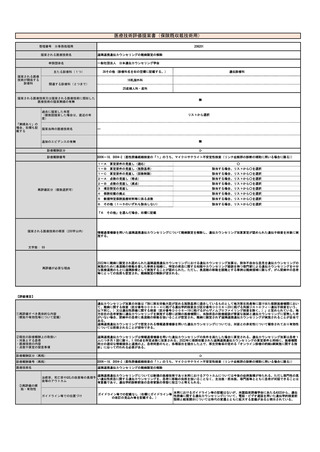
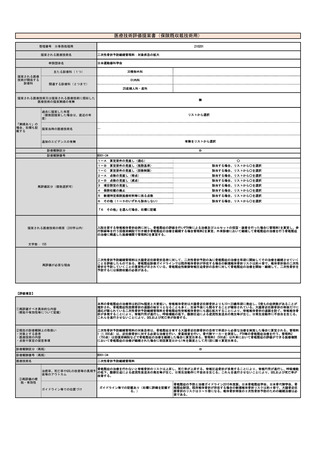
【医薬品について】
名称(販売名、一般名、
製造販売企業名)
薬事承認番号
薬価
(円)
備考
※薬事申請及び公知申請の状況等(薬事承
認見込みの場合等はその旨を記載)
MIBG集積陽性の治癒切除不能
な神経芽腫
1,072,335
円
/1.85GBq/
5mL
令和5年8月頃開催の薬事・食品衛生審議会
医薬品第一部会にて、医療上の必要性の高
い未承認薬・適応外薬検討会報告書に基づ
く公知申請に係る事前評価の終了後、保険
適用され、公知申請にて翌年2月頃に承認
見込み
薬事承認上の
「効能又は効果」
収載年月日
MIBG集積陽性の治癒切除不能
な難治性褐色細胞腫・パラガ
ングリオーマ
販売名:ライアットMIBG-I 131静注、一
般名:3-ヨードベンジルグアニジン
(131I)、製造販売企業名:PDRファー
マ(株)
30300AMX0045200
2021年11月25日
0
特になし
特になし
特になし
特になし
特になし
特になし
特になし
特になし
特になし
特になし
特になし
特になし
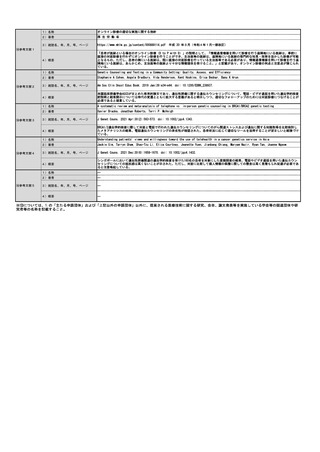
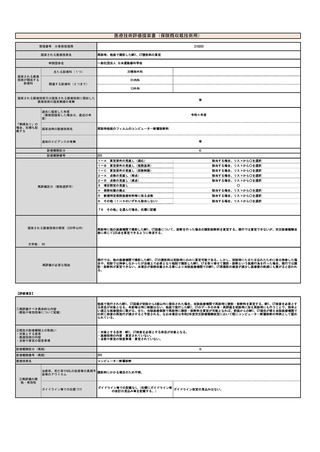
薬事承認上の
「使用目的、効能又は効果」
特定保険医療材料に該当する場合は、番
特定保険 号、名称、価格を記載
医療材料 (※薬事申請及び公知申請の状況等(薬事
承認見込みの場合等はその旨を記載)
【医療機器について】
名称(販売名、一般名、
製造販売企業名)
薬事承認番号
収載年月日
特になし
特になし
特になし
特になし
特になし
特になし
特になし
特になし
特になし
特になし
特になし
特になし
特になし
特になし
特になし
特になし
特になし
特になし
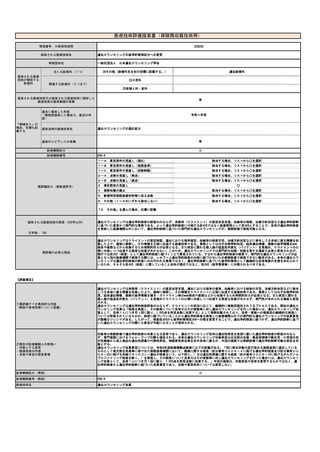
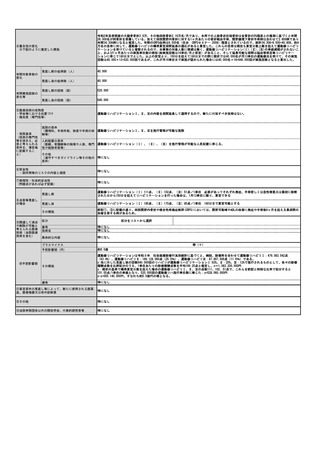
【体外診断用医薬品(検査用試薬)について】
名称(販売名、一般名、
製造販売企業名)
特になし
特になし
特になし
薬事承認番号
特になし
特になし
特になし
収載年月日
特になし
特になし
特になし
薬事承認上の「使用目的」
特になし
特になし
特になし
備考
※薬事申請及び公知申請の状況等(薬事承認見込みの
場合等はその旨を記載)
特になし
特になし
特になし
【その他記載欄(上記の欄に記載しきれない内容がある場合又は再生医療等製品を使用する場合には以下を記入すること)】
特になし
181