提案書01(0001頁~0202頁)医療技術評価・再評価提案書 (198 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190899_00011.html |
| 出典情報 | 中央社会保険医療協議会 診療報酬調査専門組織・医療技術評価分科会(令和5年度第1回 11/20)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
整理番号
215204
※事務処理用
提案される医療技術名
申請団体名
PET検査、PET/CT検査、PET/MRI検査の画像検査技術(院内製造がないPET診断薬の場合)
日本核医学会
28放射線科
主たる診療科(1つ)
提案される医療
技術が関係する
診療科
00なし
関連する診療科(2つまで)
00なし
提案される医療技術又は提案される医療技術に類似した
医療技術の提案実績の有無
有
過去に提案した年度
(複数回提案した場合は、直近の年
度)
「実績あり」の
場合、右欄も記
載する
提案当時の医療技術名
令和4年度
PET検査、PET/CT検査、PET/MRI検査の画像検査技術
無
追加のエビデンスの有無
E
診療報酬区分
診療報酬番号
再評価区分(複数選択可)
101-2、101-3、101-4
1-A
算定要件の見直し(適応)
該当する場合、リストから○を選択
1-B
算定要件の見直し(施設基準)
該当する場合、リストから○を選択
1-C
算定要件の見直し(回数制限)
該当する場合、リストから○を選択
2-A
点数の見直し(増点)
該当する場合、リストから○を選択
2-B
点数の見直し(減点)
該当する場合、リストから○を選択
3
項目設定の見直し
○
4
保険収載の廃止
該当する場合、リストから○を選択
5
新規特定保険医療材料等に係る点数
該当する場合、リストから○を選択
6
その他(1~5のいずれも該当しない)
該当する場合、リストから○を選択
「6
提案される医療技術の概要(200字以内)
その他」を選んだ場合、右欄に記載
医療機関で院内製造されず、メーカーでのみ製造され供給される医薬品を用いた場合の、がんや、脳、心臓等の疾患を診断するためのポジトロン
断層撮影(以下、PET)検査、ポジトロン断層・コンピューター断層複合撮影(以下、PET/CT)検査、ポジトロン断層・磁気共鳴コンピューター断
層複合撮影(以下、PET/MRI)検査における、各々の画像検査(薬剤の投与、撮像や画像処理及び管理区域の管理等)に係る技術である。
文字数: 200
再評価が必要な理由
PET検査に用いられる診断薬(以下、PET診断薬)には医療機器を用いた院内製造品(以下、PET薬剤)と、メーカーから供給される医薬品(以
下、PET医薬品)が存在しているが、医療機器を用いた院内製造によるPET薬剤を用いた技術の保険適用が先行したため、後発のPET医薬品を用い
た場合についても同様の技術とされ、そのPET医薬品の費用は技術料の中で包括的に取扱われている。新たに開発されたPET診断薬についても同様
の扱いとされているが、院内製造用の医療機器がない場合、又は医薬品承認が先行した場合、PET医薬品が薬事承認されても学会による医療技術
評価提案書が採択されなければ保険適用の機会がなく、また保険適用のタイミングも診療報酬改定年のみとなる。実際に、メーカーから供給され
るPET医薬品のみのPET診断薬が薬機承認を取得したが、このような経緯から、保険診療下で使えない状況が生じている。また、現在開発段階の他
のPET医薬品にも、今後、同じ状況が生じうる。
薬機承認を取得した医薬品がすぐに保険診療下で使用できないことは、本邦の患者に対して臨床上の大きな損失であり、海外と比して大きなPET
検査のドラッグラグが発生することが強く懸念される。これを解決するために再評価が必要である。
【評価項目】
①再評価すべき具体的な内容
(根拠や有効性等について記載)
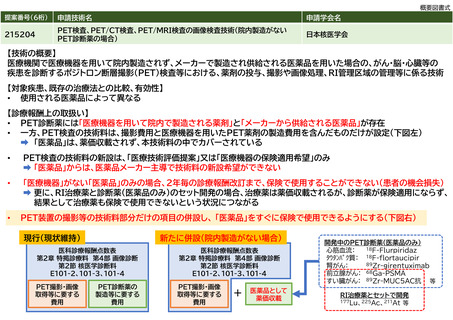
既存のPET検査、PET/CT検査、PET/MRI検査(以下、まとめてPET検査等)の診療報酬体系は「医療機器を用いた院内製造のみ(15O標識ガス、13N
標識アンモニア)」又は「医療機器を用いた院内製造とメーカーから供給される医薬品の両方(18F標識FDG)」があるPET診断薬を使用すること
を前提としている。ここに「メーカーから供給される医薬品のみ」のPET診断薬を使用する場合を対象とした項目を併設する。
新規のPET薬剤合成用の医療機器(C2)が存在する場合、医療機器メーカーはその薬機承認の取得に合わせて、保険適用希望書を提出できる。一
方、医薬品メーカーが製造するPET医薬品について、現行制度では、その薬剤費用は技術料の中で包括的に取扱われるとされ薬価基準に収載され
ない。従って、PET医薬品を保険診療下で使用するためには、先立ってそのPET医薬品を使用する技術料が項目として設立される必要があるが、
メーカーからは技術料準用の希望を申請する仕組みが存在しないため、すぐには保険適用されず、学会からの要望による診療報酬改定を経る必要
がある。
実際に、PET医薬品である「アキュミン静注」が2021年3月に薬機承認を取得したものの、「メーカーから供給される医薬品のみ」であり、現在も
保険診療下で使用できない状況が継続している。
同じ放射性医薬品を用いるSPECT検査は、院内製造が行われずメーカーから供給される医薬品のみとなっており、その技術料は医薬品の費用を含
まない形で設定され、使用される医薬品の薬剤費は薬価が利用できることとされている。そのため、SPECT検査用の医薬品は薬価基準に収載され
ることで、薬機承認後に遅滞なく保険診療下で使用できる環境が整っている。
そこで、「メーカーから供給される医薬品のみ」のPET医薬品を用いた場合について、SPECT検査の技術と同様に、医薬品の費用を含まない技術を
既存の項目に併設することで、薬機承認後すぐに保険診療下で使える環境が整うこととなる。
なお、「医療機器を用いた院内製造のみ」「医療機器を用いた院内製造とメーカーから供給される医薬品の両方」のPET診断薬を用いた検査につ
いては、現状の実績や患者負担の整合性等の点から現行制度が必要である。
198