提案書02(0203頁~0398頁)医療技術評価・再評価提案書 (34 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190899_00011.html |
| 出典情報 | 中央社会保険医療協議会 診療報酬調査専門組織・医療技術評価分科会(令和5年度第1回 11/20)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
※下記のように推定した根拠
年間対象者数の
変化
年間実施回数の
変化等
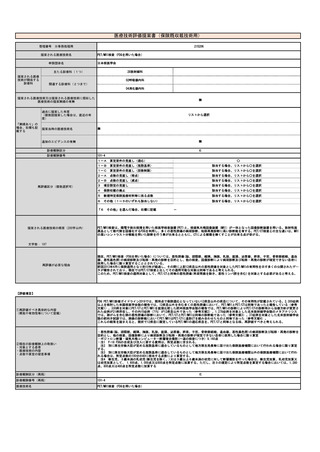
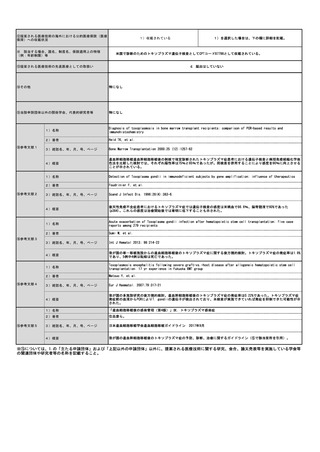
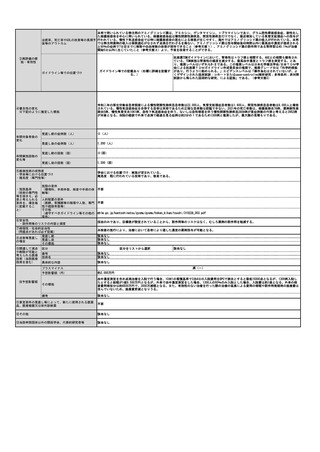
見直し前の症例数(人)
0
見直し後の症例数(人)
2,000
見直し前の回数(回)
1,440,000
見直し後の回数(回)
1,442,000
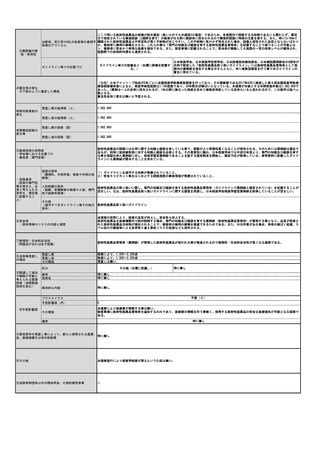
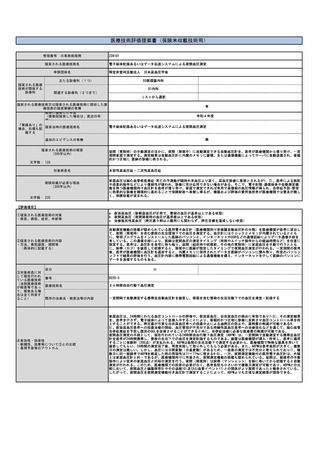
⑤医療技術の成熟度
・学会等における位置づけ
・難易度(専門性等)
・施設基準
(技術の専門性
等を踏まえ、必
要と考えられる
要件を、項目毎
に記載するこ
と)
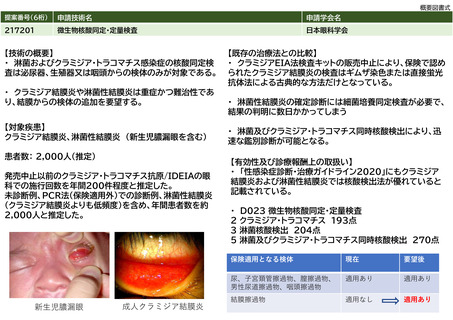
社会医療診療行為別統計ではD012クラミジア・トラコマチス抗原定性の算定回数は11,420回(2017年)から3,514回(2021年)へ減っていること
からクラミジアEIA法検査キットの施行回数は8,000回程度だったと推定されるが、これは全診療科の算定回数である。2017年度の社会保険支払基
金における眼科からの請求件数は年間80件程度で、国保も含めた眼科全体では年間200件程度だったと推定される。全診療科の2.5%に相当するこ
とになり、妥当な数字である。これら200件に加え、今まで保険請求されずにPCR法が行われていた症例が今後は保険請求すると考えられる。淋菌
性結膜炎および新生児膿漏眼の患者数は成人クラミジア結膜炎に比べて少ない。本要望が認められた場合の実施回数の増加は多く見積もっても
2,000人程度と推定した。
2020年のNDBオープンデータによると、D023微生物核酸同定・定量検査において、2クラミジア・トラコマチス 713,507件、3 淋菌 32,854件、5
淋菌及びクラミジア・トラコマチス 693,354件であり、合計すると、1,439,715件で、およそ1,440,000件となる。眼科が追加されることになると
2,000件が加わることになり、1,442,000件になると予想される。
「性感染症診断・治療ガイドライン2020」(日本性感染症学会)にはクラミジア結膜炎の確定診断に必要な検査としてギムザ染色による封入体の
同定、クラミジアの抗原同定(EIA法、免疫クロマト法)、核酸検出法(保険適応外)が有効であると記載されている。また、淋菌性結膜炎の確
定診断に必要な検査として、塗抹検査、培養同定検査、核酸増幅法が記載されている。検体採取方法はいずれも結膜の擦過であり、結膜炎全般の
検体採取で施行される一般的で安全な方法である。
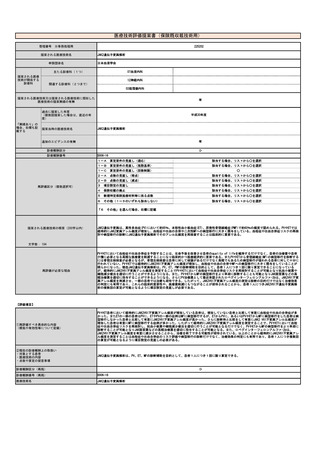
施設の要件
(標榜科、手術件数、検査や手術の体 特別な施設の要件を必要としない。
制等)
人的配置の要件
(医師、看護師等の職種や人数、専門 特別な人的配置の要件を必要としない。
性や経験年数等)
その他
(遵守すべきガイドライン等その他の 特になし。
要件)
⑥安全性
・副作用等のリスクの内容と頻度
結膜擦過物の採取はアデノウイルス抗原定性の際にも行われる一般的で安全な手技である。下眼瞼結膜円蓋部で行われることが多く、副作用は擦
過後の違和感程度である。
⑦倫理性・社会的妥当性
(問題点があれば必ず記載)
問題なし。
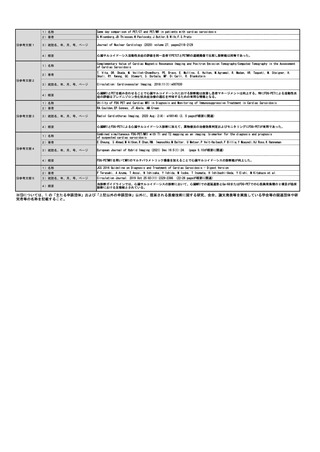
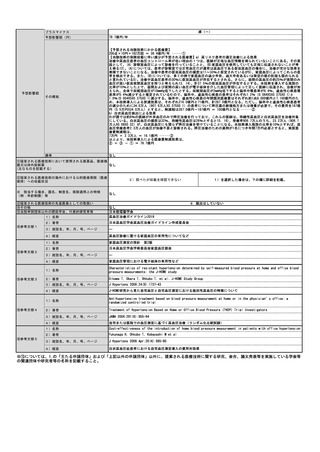
⑧点数等見直し
の場合
見直し前
見直し後
その根拠
該当せず
該当せず
該当せず
区分
⑨関連して減点
や削除が可能と
考えられる医療
技術(当該医療
技術を含む)
特になし
その他(右欄に記載。)
番号
技術名
該当せず
該当せず
具体的な内容
該当せず
増(+)
プラスマイナス
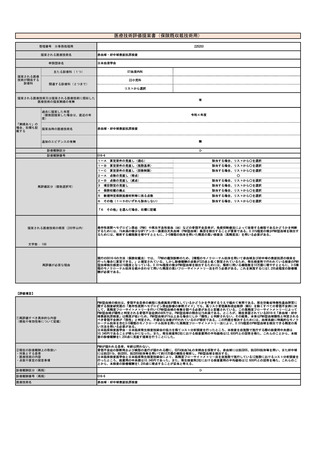
⑩予想影響額
予想影響額(円)
4,000,000
その根拠
これまでD012-27クラミジア・トラコマチス抗原定性(156点)を算定していた症例(200例)および保険請求せずクラミジア結膜炎の診断・治療
が行われていた症例(1,600例)、D018細菌培養同定検査(170点)を算定していた淋菌性結膜炎の症例(200例)の合計2,000例うち、800例に2ク
ラミジア・トラコマチス(193点)、200例に3淋菌核酸検出(204点)、1,000例に5淋菌及びクラミジア・トラコマチス同時核酸検出(270点)が
行われると予想される。よって、{(193×800+204×200+270×1,000)-156×200-170×200}×10(円)=4,000,000円の増になると思われ
る。
備考
これまで保険請求せずリアルタイムPCR法を施行していた症例が今後保険請求することになる可能性がある。
⑪算定要件の見直し等によって、新たに使用される医薬
品、医療機器又は体外診断薬
なし
⑫その他
特になし
⑬当該申請団体以外の関係学会、代表的研究者等
特になし
236