総ー1○個別改定項目(その2)について (742 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00245.html |
| 出典情報 | 中央社会保険医療協議会 総会(第582回 1/31)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(3) 当該保険医療機関において調剤したバイオ後続品のある先発バイ
オ医薬品(バイオ後続品の適応のない患者に対して使用する先発バ
イオ医薬品は除く。)及びバイオ後続品について、当該薬剤を合算し
た規格単位数量に占めるバイオ後続品の規格単位数量の割合につ
いて、以下のいずれも満たすこと。
イ 次に掲げる成分について、当該保険医療機関において調剤した
先発バイオ医薬品(バイオ後続品の適応のない患者に対して使用
する先発バイオ医薬品は除く。)及びバイオ後続品について、当該
成分全体の規格単位数量に占めるバイオ後続品の規格単位数量の
割合が●●%以上であること。ただし、当該成分の規格単位数量
が●●未満の場合を除く。
① エポエチン
② リツキシマブ
③ トラスツズマブ
④ テリパラチド
ロ 次に掲げる成分について、当該保険医療機関において調剤した
先発バイオ医薬品(バイオ後続品の適応のない患者に対して使用
する先発バイオ医薬品は除く。)及びバイオ後続品について、当該
成分全体の規格単位数量に占めるバイオ後続品の規格単位数量の
割合が●●%以上であること。ただし、当該成分の規格単位数量
が●●未満の場合を除く。
① ソマトロピン
② インフリキシマブ
③ エタネルセプト
④ アガルシダーゼベータ
⑤ ベバシズマブ
⑥ インスリンリスプロ
⑦ インスリンアスパルト
⑧ アダリムマブ
⑨ ラニビズマブ
(4)バイオ後続品の使用に積極的に取り組んでいる旨を、当該保険医
療機関の見やすい場所に掲示していること。
(5)
(4)の掲示事項について、原則として、ウェブサイトに掲載して
いること。
[施設基準]
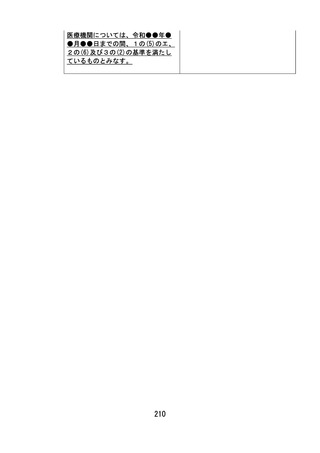
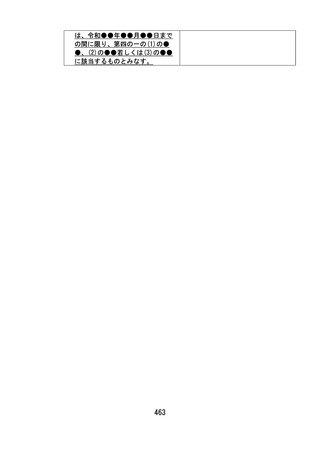
令和●年●月●日までの間に限り、(5)に該当するものとみなす。
730