資料1-2-3-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・集計対象期間における基礎疾患等及び症例経過)[694KB] (189 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_00106.html |
| 出典情報 | 厚生科学審議会・薬事審議会(合同開催) 予防接種・ワクチン分科会副反応検討部会(第102回 7/29)医薬品等安全対策部会安全対策調査会(令和6年度第4回 7/29)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
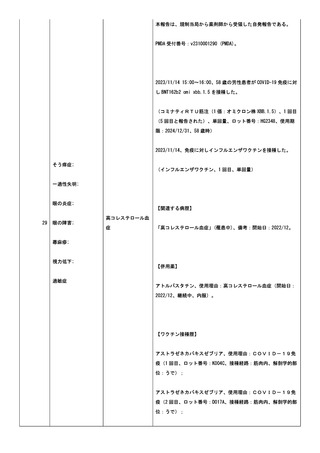
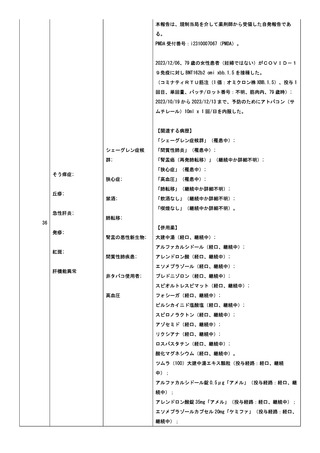
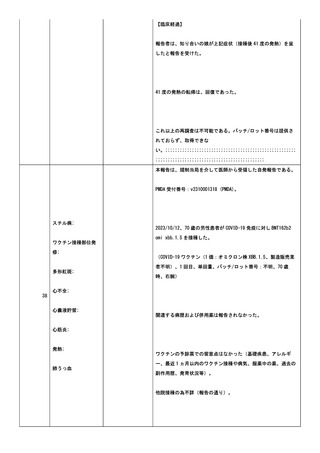
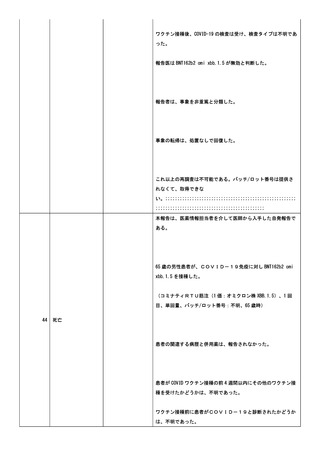
小板減少症、免疫性血小板減少症、抗リン脂質抗体症候群、血栓
性微小血管症、播種性血管内凝固症候群、発作性夜間ヘモグロビ
ン尿症。
COVID-19 の罹患歴:なし。
ヘパリンの投与歴(発症日までの 100 日間の投与の有無を記
載):なし。
血栓のリスクとなる因子:あり。発症時に以下の状態があればチ
ェックを入れ、疾患名を記載:感染症。(疾患名;感染性心内膜
炎
疑)
血栓症(血栓塞栓症を含む)(血小板減少症を伴うものに限る)
(TTS)調査票。
臨床症状/所見:新型コロナワクチン接種後に、新規に発症した
症状/所見にチェックを入れ、発症日を西暦で記載:意識障害
(2024/02/21);半側空間無視(2024/02/21);失語症/構音障害
(2024/02/21);
2.検査所見:初回検査日(2024/02/21):
<血算>:スミアでの凝集所見は未実;施。
赤血球数:3610000/uL;ヘマトクリット:32.4%。血小板数:
310000/uL。
<凝固系検査>:PT:12.9 秒;PT-INR:1;フィブリノゲン:
1129mg/dL。
抗血小板第 4 因子抗体、抗 HIT 抗体は未実施。
SARS-CoV-2検査(2024/02/21):陰性。検査方法:核
酸増幅法(PCR/ LAMP)。
その他の特記すべき検査はなかった。