資料1-2-3-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・集計対象期間における基礎疾患等及び症例経過)[694KB] (85 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_00106.html |
| 出典情報 | 厚生科学審議会・薬事審議会(合同開催) 予防接種・ワクチン分科会副反応検討部会(第102回 7/29)医薬品等安全対策部会安全対策調査会(令和6年度第4回 7/29)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ら受領した自発報告である。
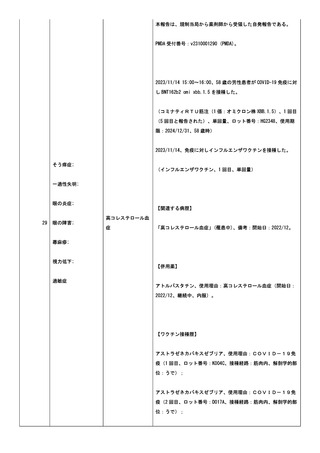
PMDA 受付番号:v2310001272 (PMDA)。
2023/09/29、77 歳の女性患者が COVID-19 免疫に対し BNT162b2
omi xbb.1.5 を接種した。
(コミナティRTU筋注(1 価:オミクロン株 XBB.1.5)、1 回
目、単回量、ロット番号:HG2251、使用期限:2024/11/30、77 歳
時、筋肉内)。
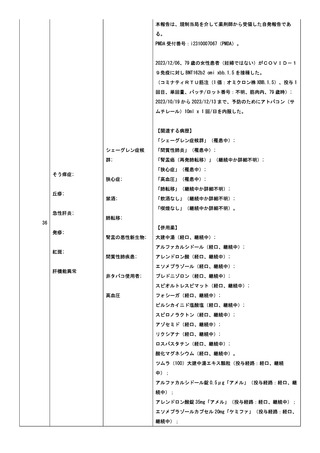
ワクチンの予診票での留意点はあった(基礎疾患、アレルギー、
最近 1 ヶ月以内のワクチン接種や病気、服薬中の薬、過去の副作
用歴、発育状況など):定期血液透析加療中である。
播種性血管内凝固;
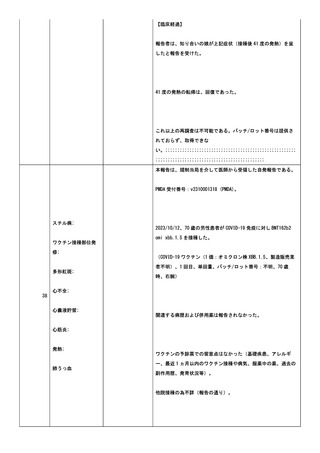
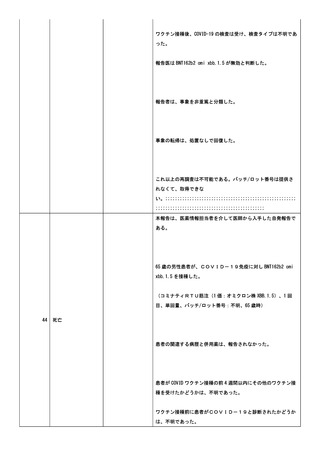
28
血液透析
家族歴上、ワクチンの過敏反応はない。
皮膚血管炎
患者の併用薬は報告されなかった。
【ワクチン接種歴】
コミナティ、使用理由:COVID-19 免疫(5 回目(追加免疫)、単
回量、筋肉内、接種日:2022/11/21);
コミナティ、使用理由:COVID-19 免疫(6 回目(追加免疫)、単
回量、筋肉内、接種日:2023/05/19);
COVID-19 ワクチン、使用理由:COVID-19 免疫(1 回目、単回量、
製造販売業者不明);
COVID-19 ワクチン、使用理由:COVID-19 免疫(2 回目、単回量、
製造販売業者不明);